Glucophage for behandling av diabetes
Merkenavn: Glucophage
Generisk navn: metforminhydroklorid
Doseringsform: tabletter med utvidet utgivelse
Innhold:
Beskrivelse
Klinisk farmakologi
Indikasjoner og bruk
Kontra
advarsler
forholdsregler
Narkotikahandel
Bivirkninger
Overdose
Dosering
Medfølgende
Glukohage, metforminhydroklorid, pasientinformasjon (på vanlig engelsk)
Beskrivelse
Glucophage® (metformin hydrochloride) tabletter og Glucophage® XR (metformin hydrochloride) tabletter med utvidet frigivelse er orale antihyperglykemiske medisiner som brukes til behandling av type 2 diabetes. Metforminhydroklorid (N, N-dimetylimidodikarbonimidisk diamidhydroklorid) er ikke kjemisk eller farmakologisk relatert til noen andre klasser av orale antihyperglykemiske midler. Strukturformelen er som vist:
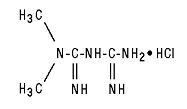
Metforminhydroklorid er en hvit til off-white krystallinsk forbindelse med en molekylformel av C4H11N5 - HCl og en molekylvekt på 165,63. Metforminhydroklorid er fritt oppløselig i vann og er praktisk talt uoppløselig i aceton, eter og kloroform. PKa for metformin er 12,4. PH i en 1% vandig løsning av metforminhydroklorid er 6,68.
Glucophagetabletter inneholder 500 mg, 850 mg eller 1000 mg metforminhydroklorid. Hver tablett inneholder de inaktive ingrediensene povidon og magnesiumstearat. I tillegg inneholder belegget for 500 mg og 850 mg tabletter hypromellose og belegget for 1000 mg tablett inneholder hypromellose og polyetylenglykol.
Glucophage XR inneholder 500 mg eller 750 mg metforminhydroklorid som den aktive ingrediensen.
Glucophage XR 500 mg tabletter inneholder de inaktive ingrediensene natriumkarboksymetylcellulose, hypromellose, mikrokrystallinsk cellulose og magnesiumstearat.
Glucophage XR 750 mg tabletter inneholder de inaktive ingrediensene natriumkarboksymetylcellulose, hypromellose og magnesiumstearat.
Systemkomponenter og Performance-Glucophage XR omfatter et dobbelt hydrofilt polymermatrikssystem. Metforminhydroklorid kombineres med en medikamentfrigjøringskontrollerende polymer for å danne en "indre" fase, som deretter inkorporeres som separate partikler i en "ekstern" fase av en andre polymer. Etter administrering kommer væske fra mage-tarmkanalen inn i tabletten, noe som får polymerene til å hydratere og svelle. Legemiddel frigjøres sakte fra doseringsformen ved en diffusjonsprosess gjennom gelmatrisen som er vesentlig uavhengig av pH. Det hydratiserte polymersystemet er ikke stivt og forventes å bli brutt opp ved normal peristaltikk i GI-kanalen. De biologisk inerte komponentene av tabletten kan noen ganger forbli intakte under GI-transitt og vil bli eliminert i avføringen som en myk, hydratisert masse.
topp
Klinisk farmakologi
Virkningsmekanismen
Metformin er et antihyperglykemisk middel som forbedrer glukosetoleransen hos pasienter med type 2-diabetes, og senker både basal og postprandial plasmaglukose. Dets farmakologiske virkningsmekanismer er forskjellige fra andre klasser av orale antihyperglykemiske midler. Metformin reduserer glukoseproduksjonen i leveren, reduserer intestinal absorpsjon av glukose og forbedrer insulinfølsomheten ved å øke perifert glukoseopptak og utnyttelse. I motsetning til sulfonylurinstoffer, produserer metformin ikke hypoglykemi hos verken pasienter med type 2-diabetes eller normale personer (unntatt under spesielle omstendigheter, se FORHOLDSREGLER) og forårsaker ikke hyperinsulinemi. Med metforminbehandling forblir insulinsekresjonen uendret mens fastende insulinnivå og dagen lang plasma-insulinrespons faktisk kan avta.
farmakokinetikk
Absorpsjon og biotilgjengelighet
Den absolutte biotilgjengeligheten av en Glucophage 500 mg tablett gitt under fasteforhold er omtrent 50% til 60%. Studier som bruker enkle orale doser med Glucophage 500 til 1500 mg og 850 til 2550 mg, indikerer at det er mangel på doseproporsjonalitet med økende doser, noe som skyldes nedsatt absorpsjon i stedet for en endring i eliminering. Mat reduserer omfanget av og forsinker absorpsjonen av metformin litt, som vist med omtrent 40% lavere gjennomsnittlig toppplasma konsentrasjon (Cmax), et 25% lavere område under plasmakonsentrasjonen versus tidskurven (AUC), og en 35-minutters forlengelse av tiden til toppen plasmakonsentrasjon (Tmax) etter administrering av en enkelt 850 mg tablett metformin sammen med mat, sammenlignet med samme tablettstyrke administrert faste. Den kliniske relevansen av disse synkelsene er ukjent.
Etter en enkelt oral dose Glucophage XR oppnås Cmax med en medianverdi på 7 timer og et område fra 4 til 8 timer. Topp plasmanivåer er omtrent 20% lavere sammenlignet med samme dose Glucophage, men absorpsjonsgraden (som målt ved AUC) er lik Glucophage.
Ved stabil tilstand er AUC og Cmax mindre enn dose proporsjonalt for Glucophage XR i området 500 til 2000 mg administrert en gang daglig. Topp plasmanivå er ca. 0,6, 1,1, 1,4 og 1,8 ug / ml for henholdsvis 500, 1000, 1500 og 2000 mg doser én gang daglig. Omfanget av metforminabsorpsjon (målt ved AUC) fra Glucophage XR i en dose på 2000 mg en gang daglig, tilsvarer den samme totale daglige dosen administrert som Glucophage tabletter 1000 mg to ganger daglig. Etter gjentatt administrering av Glucophage XR akkumulerte metformin seg ikke i plasma.
Variasjon innen faget i Cmax og AUC for metformin fra Glucophage XR er sammenlignbar med den med Glucophage.
Selv om omfanget av metforminabsorpsjon (som målt ved AUC) fra Glucophage XR tablett økte med omtrent 50% når det ble gitt med mat, det var ingen effekt av mat på Cmax og Tmax av metformin. Både måltider med høyt og lite fett hadde samme effekt på farmakokinetikken til Glucophage XR.
Fordeling
Det tilsynelatende distribusjonsvolumet (V / F) av metformin etter enkle orale doser Glucophage 850 mg var i gjennomsnitt 654 ± 358 L. Metformin er ubetydelig bundet til plasmaproteiner, i motsetning til sulfonylurea, som er mer enn 90% proteinbundet. Metformin-partisjoner i erytrocytter, mest sannsynlig som en funksjon av tiden. Ved vanlige kliniske doser og doseplaner for Glucophage oppnås plasmakonsentrasjonen av metformin ved jevn tilstand innen 24 til 48 timer og er generelt
Metabolisme og eliminering
Intravenøse enkeltdosestudier hos normale forsøkspersoner viser at metformin skilles ut uendret i urin og gjennomgår ikke levermetabolisme (ingen metabolitter er blitt identifisert hos mennesker) og heller ikke gallegang utskillelse. Nyreavklaring (se Tabell 1) er omtrent 3,5 ganger større enn kreatininclearance, noe som indikerer at tubulær sekresjon er den viktigste ruten for eliminering av metformin. Etter oral administrering elimineres omtrent 90% av det absorberte medikamentet via nyreveien i løpet av de første 24 timene, med en plasma eliminasjonshalveringstid på omtrent 6,2 timer. I blod er eliminasjonshalveringstiden omtrent 17,6 timer, noe som antyder at erytrocyttmassen kan være et distribusjonsrom.
Spesielle befolkninger
Pasienter med diabetes type 2
I nærvær av normal nyrefunksjon er det ingen forskjeller mellom enkelt- eller multidosefarmakokinetikk av metformin mellom pasienter med diabetes type 2 og normale personer (se Tabell 1), og det er heller ingen akkumulering av metformin i noen gruppe ved vanlige kliniske doser.
Farmakokinetikken til Glucophage XR hos pasienter med diabetes type 2 er sammenlignbar med dem hos friske, normale voksne.
Nedsatt nyrefunksjon
Hos pasienter med nedsatt nyrefunksjon (basert på målt kreatininclearance) er plasma og blodhalveringstid metformin er langvarig og nyreclearance reduseres i forhold til reduksjonen i kreatininclearance (se Tabell 1; også se ADVARSLER).
Nedsatt leverfunksjon
Det er ikke utført farmakokinetiske studier av metformin hos pasienter med nedsatt leverfunksjon.
geriatri
Begrensede data fra kontrollerte farmakokinetiske studier av glukofage hos friske eldre personer antyder at total plasma clearance av metformin reduseres, halveringstiden forlenges, og Cmax økes sammenlignet med friske unge fag. Av disse dataene ser det ut til at endringen i metformin farmakokinetikk med aldring først og fremst skyldes en endring i nyrefunksjon (se Tabell 1). Glucophage (metformin hydrochloride) tabletter og Glucophage XR (metformin hydrochloride) Behandling med utvidede utgivelser initieres hos pasienter på 80 år, med mindre måling av kreatininclearance viser at nyrefunksjonen ikke er redusert (se ADVARSLER og DOSERING OG ADMINISTRASJON).
Tabell 1: Velg middel (± S.D.) Metformin farmakokinetiske parametere etter enkelt eller flere orale doser av glukofag
| Emnegrupper: glukofagedoseen (antall fag) |
Cmaxb (ug / ml) |
Tmaxc (timer) |
Renal clearance (Ml / min) |
|---|---|---|---|
| en Alle doser som fikk faste, bortsett fra de første 18 dosene av multiple dosestudiene | |||
| b Topp plasmakonsentrasjon | |||
| c På tide å maksimere plasmakonsentrasjonen | |||
| d Kombinerte resultater (gjennomsnittlig middel) av fem studier: gjennomsnittsalder 32 år (område 23-59 år) | |||
| e Kinetisk studie gjort etter dose 19, gitt faste | |||
| f Eldre personer, gjennomsnittsalder 71 år (område 65-81 år) | |||
| g CLcr = kreatininclearance normalisert til kroppsoverflate på 1,73 moh2 | |||
| Friske, ikke-diabetiske voksne: | |||
| 500 mg enkeltdose (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg enkeltdose (74)d | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 850 mg tre ganger daglig i 19 dosere (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Voksne med diabetes type 2: | |||
| 850 mg enkeltdose (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 850 mg tre ganger daglig i 19 dosere (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| eldreF, friske ikke-diabetiske voksne: | |||
| 850 mg enkeltdose (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Nedsatt nyrefunksjon: | |||
| 850 mg enkeltdose | |||
| Mild (CLcrg 61-90 ml / min) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Moderat (CLcr 31-60 ml / min) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Alvorlig (CLcr 10-30 ml / min) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
Pediatrics
Etter administrering av en enkelt oral Glucophage 500 mg tablett sammen med mat, skilte det geometriske middelmetormin Cmax og AUC seg mindre enn 5% mellom pediatriske diabetespasienter av type 2 (12-16 år) og sunne voksne med kjønn og vekt, (20-45 år), alle med normalt nyre funksjon
Kjønn
Metformins farmakokinetiske parametere skilte seg ikke signifikant mellom normale personer og pasienter med diabetes type 2 når de ble analysert i henhold til kjønn (menn = 19, kvinner = 16). Tilsvarende, i kontrollerte kliniske studier på pasienter med diabetes type 2, var den antihyperglykemiske effekten av Glucophage sammenlignbar hos menn og kvinner.
Løp
Det er ikke utført studier av farmakokinetiske metforminparametere i henhold til rase. I kontrollerte kliniske studier av Glucophage hos pasienter med diabetes type 2, var den antihyperglykemiske effekten sammenlignbar hos hvite (n = 249), svarte (n = 51) og Hispanics (n = 24).
Kliniske studier
Glucophage
I en dobbeltblind, placebokontrollert, multisenter amerikansk klinisk studie som involverte overvektige pasienter med type 2-diabetes hvis hyperglykemi ikke var tilstrekkelig kontrollert med kostholdshåndtering alene (baseline-fastende plasmaglukose [FPG] på omtrent 240 mg / dL), behandling med Glucophage (opptil 2550 mg / dag) i 29 uker resulterte i betydelig gjennomsnittlig nettoreduksjon i henholdsvis faste og postprandial plasmaglukose (PPG) og hemoglobin A1c (HbA1c) på henholdsvis 59 mg / dL, 83 mg / dL og 1,8%, sammenlignet med placebogruppen (se Tabell 2).
Tabell 2: Glucophage vs Placebo Sammendrag av gjennomsnittsendringer fra baseline * i fastende plasmaglukose, HbA1c, og kroppsvekt, ved endelig besøk (29-ukers studie)
| Glucophage (N = 141) |
placebo (N = 145) |
p-verdi | |
|---|---|---|---|
| * Alle pasienter på diettterapi ved baseline | ** Ikke statistisk signifikant | ||
| FPG (mg / dL) Grunnlinje Endre ved ENDELIG BESØK |
241.5 -53.0 |
237.7 6.3 |
NS ** 0.001 |
| Hemoglobin A1c (%) Grunnlinje Endre ved ENDELIG BESØK |
8.4 -1.4 |
8.2 0.4 |
NS ** 0.001 |
| Kroppsvekt (kg) Grunnlinje Endre ved ENDELIG BESØK |
201.0 -1.4 |
206.0 -2.4 |
NS ** NS ** |
En 29-ukers, dobbeltblind, placebokontrollert studie av Glucophage og glyburid, alene og i kombinasjon, ble utført hos overvektige pasienter med type 2 diabetes som ikke hadde oppnådd tilstrekkelig glykemisk kontroll under maksimale doser av glyburid (grunnleggende FPG på omtrent 250 mg / dL) (se tabell 3). Pasienter som ble randomisert til kombinasjonsarmen startet behandling med Glucophage 500 mg og 20 mg glyburide. På slutten av hver uke i de første 4 ukene av forsøket hadde disse pasientene dosene av Glucophage økt med 500 mg hvis de ikke hadde nådd målet med fastende plasmaglukose. Etter uke 4 ble slike doseringsjusteringer foretatt månedlig, selv om ingen pasienter fikk lov til å overskride Glucophage 2500 mg. Pasienter i bare Glucophage-armen (metformin pluss placebo) fulgte den samme titreringsplanen. Ved slutten av studien tok omtrent 70% av pasientene i kombinasjonsgruppen Glucophage 2000 mg / glyburide 20 mg eller Glucophage 2500 mg / glyburide 20 mg. Pasienter som ble randomisert for å fortsette på glyburid, opplevde forverring av glykemisk kontroll, med gjennomsnittlig økning i FPG, PPG og HbA1c på henholdsvis 14 mg / dL, 3 mg / dL og 0,2%. Derimot opplevde de som ble randomisert til Glucophage (opptil 2500 mg / dag) en liten forbedring, med gjennomsnittlige reduksjoner i henholdsvis FPG, PPG og HbA1c på 1 mg / dL, 6 mg / dL og 0,4%. Kombinasjonen av glukofag og glyburid var effektiv for å redusere FPG-, PPG- og HbA1c-nivåer med henholdsvis 63 mg / dL, 65 mg / dL og 1,7%. Sammenlignet med resultatene av glyburidbehandling alene var nettoforskjellene med kombinasjonsbehandling henholdsvis -77 mg / dL, -68 mg / dL og -1,9% (se tabell 3).
Tabell 3: Kombinert Glucophage / Glyburide (Comb) vs Glyburide (Glyb) eller Glucophage (GLU) monoterapi: Sammendrag av gjennomsnittsendringer fra baseline * for fasting Plasma Glucose, HbA1c, og kroppsvekt, ved endelig besøk (29-ukers studie)
| p-verdiene | ||||||
|---|---|---|---|---|---|---|
| Kam (N = 213) |
Glyb (N = 209) |
GLU (N = 210) |
Glyb vs Kam |
GLU vs Kam |
GLU vs Glyb |
|
| * Alle pasienter på glyburid, 20 mg / dag, ved baseline | ** Ikke statistisk signifikant | |||||
| Fastende plasmaglukose (mg / dL) | ||||||
| Grunnlinje Endre ved ENDELIG BESØK |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS ** 0.001 |
NS ** 0.001 |
NS ** 0.025 |
| Hemoglobin A1c (%) | ||||||
| Grunnlinje Endre ved ENDELIG BESØK |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS ** 0.001 |
NS ** 0.001 |
0.007 0.001 |
| Kroppsvekt (kg) | ||||||
| Grunnlinje Endre ved ENDELIG BESØK |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS ** 0.011 |
NS ** 0.001 |
NS ** 0.001 |
Størrelsen på nedgangen i fastende blodsukkerkonsentrasjon etter institusjonen av Glucophage (metforminhydroklorid) tabletterbehandling var proporsjonal med fastenivået hyperglykemi. Pasienter med diabetes type 2 med høyere faste glukosekonsentrasjoner opplevde større fall i plasmaglukose og glykosylert hemoglobin.
I kliniske studier senket Glucophage, alene eller i kombinasjon med en sulfonylurea, gjennomsnittlig fastende serum triglyserider, total kolesterol og LDL-kolesterolnivå, og hadde ingen skadelige effekter på andre lipidnivåer (se Tabell 4).
Tabell 4: Sammendrag av gjennomsnittlig prosentvis endring fra baseline for store serumlipidvariabler ved endelig besøk (29-ukers studier)
| Glucophage vs Placebo | Kombinert Glucophage / Glyburide vs monoterapi |
||||
|---|---|---|---|---|---|
| Glucophage (N = 141) |
placebo (N = 145) |
Glucophage (N = 210) |
Glucophage / Glyburide (N = 213) |
Glyburide (N = 209) |
|
| Totalt kolesterol (mg / dL) | |||||
| Grunnlinje Gjennomsnitt% endring ved ENDELIG BESØK |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Totalt triglyserider (mg / dL) | |||||
| Grunnlinje Gjennomsnitt% endring ved ENDELIG BESØK |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| LDL-kolesterol (mg / dL) | |||||
| Grunnlinje Gjennomsnitt% endring ved ENDELIG BESØK |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| HDL-kolesterol (mg / dL) | |||||
| Grunnlinje Gjennomsnitt% endring ved ENDELIG BESØK |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
I motsetning til sulfonylurea, hadde kroppsvekten til personer på Glucophage en tendens til å forbli stabil eller til og med redusere noe (se Tabeller 2 og 3).
En 24-ukers, dobbeltblind, placebokontrollert studie av Glucophage pluss insulin kontra insulin pluss placebo var utført hos pasienter med diabetes type 2 som ikke klarte å oppnå tilstrekkelig glykemisk kontroll på insulin alene (se Tabell 5). Pasienter som ble randomisert for å få Glucophage pluss insulin oppnådde en reduksjon i HbA1c på 2,10%, sammenlignet med en 1,56% reduksjon i HbA1c oppnådd med insulin pluss placebo. Forbedringen i glykemisk kontroll ble oppnådd ved det endelige studiebesøket med henholdsvis 16% mindre insulin, 93,0 U / dag mot 110,6 U / dag, Glucophage pluss insulin versus insulin pluss placebo, p = 0,04.
Tabell 5: Kombinert glukofage / insulin mot placebo / insulin Sammendrag av gjennomsnittsendringer fra baseline i HbA1c og daglig insulindose
| Glucophage / Insulin (N = 26) |
placebo / Insulin (N = 28) |
Behandling Forskjell Gjennomsnitt ± SE |
|
|---|---|---|---|
|
en Statistisk signifikant ved bruk av analyse av samvariasjon med baseline som kovariat (p = 0,04) Ikke signifikant ved bruk av variansanalyse (verdier vist i tabell) | |||
| b Statistisk signifikant for insulin (p = 0,04) | |||
| Hemoglobin A1c (%) | |||
| Grunnlinje Endre ved ENDELIG BESØK |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43en |
| Insulin dosering (U / dag) | |||
| Grunnlinje Endre ved ENDELIG BESØK |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77b |
En andre dobbeltblind, placebokontrollert studie (n = 51), med 16 ukers randomisert behandling, viste at hos pasienter med diabetes type 2 kontrollert med insulin i 8 uker med en gjennomsnittlig HbA1c på 7,46 ± 0,97%, opprettholdt tilsetningen av Glucophage lignende glykemisk kontroll (HbA1c 7,15 ± 0,61 vs 6,97 ± 0,62 for Glucophage pluss insulin og placebo pluss henholdsvis insulin med 19% mindre insulin i forhold til basislinjen (reduksjon på 23,68 ± 30,22 mot en økning på 0,43 ± 25,20 enheter for Glucophage pluss insulin og placebo pluss insulin, p <0,01). I tillegg demonstrerte denne studien at kombinasjonen av glukofag pluss insulin resulterte i reduksjon i kroppsvekt på 3,11 ± 4,30 kg, sammenlignet med en økning på 1,30 ± 6,08 pund for placebo pluss insulin, p = 0,01.
Glucophage XR
En 24-ukers, dobbeltblind, placebokontrollert studie av Glucophage XR, tatt en gang daglig med kveldsmåltidet, ble utført i pasienter med diabetes type 2 som ikke hadde oppnådd glykemisk kontroll med kosthold og trening (HbA1c 7,0% -10,0%, FPG 126-270 mg / dl). Pasienter som deltok i studien hadde en gjennomsnittlig basislinje HbA1c på 8,0% og en gjennomsnittlig basislinje-FPG på 176 mg / dL. Etter 12 ukers behandling hadde gjennomsnittlig HbA1c økt fra baseline med 0,1% og gjennomsnittlig FPG redusert fra baseline med 2 mg / dL i placebogruppen, sammenlignet med en reduksjon i gjennomsnittlig HbA1c på 0,6% og en reduksjon i gjennomsnittlig FPG på 23 mg / dL hos pasienter behandlet med Glucophage XR 1000 mg en gang daglig. Deretter ble behandlingsdosen økt til 1500 mg en gang daglig hvis HbA1c var 7,0% men <8,0% (pasienter med HbA1c - 8,0% ble avviklet fra studien). Ved siste besøk (24-ukers) hadde gjennomsnittlig HbA1c økt 0,2% fra baseline hos placebopasienter og redusert 0,6% med Glucophage XR.
En 16-ukers, dobbeltblind, placebokontrollert, doseresponsstudie av Glucophage XR, tatt en gang daglig med kveldsmåltidet eller to ganger daglig med måltider, ble utført hos pasienter med diabetes type 2 som ikke hadde oppnådd glykemisk kontroll med kosthold og trening (HbA1c 7,0% -11,0%, FPG 126-280 mg / dl). Endringer i glykemisk kontroll og kroppsvekt er vist i tabell 6.
Tabell 6: Sammendrag av gjennomsnittsendringer fra baseline * i HbA1c, Fastende plasmaglukose og kroppsvekt ved endelig besøk (16-ukers studie)
| Glucophage XR | placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg En gang Daglig |
1000 mg En gang Daglig |
1500 mg En gang Daglig |
2000 mg En gang Daglig |
1000 mg To ganger Daglig |
||
| * Alle pasienter på diettterapi ved baseline | ||||||
| en Alle sammenligninger kontra Placebo | ||||||
| ** Ikke statistisk signifikant | ||||||
| Hemoglobin A1c (%) | (N = 115) | (N = 115) | (N = 111) | (N = 125) | (N = 112) | (N = 111) |
| Grunnlinje | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| Endre ved ENDELIG BESØK | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| p-verdienen | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dL) | (N = 126) | (N = 118) | (N = 120) | (N = 132) | (N = 122) | (N = 113) |
| Grunnlinje | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| Endre ved ENDELIG BESØK | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| p-verdienen | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Kroppsvekt (kg) | (N = 125) | (N = 119) | (N = 117) | (N = 131) | (N = 119) | (N = 113) |
| Grunnlinje | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| Endre ved ENDELIG BESØK | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| p-verdienen | NS ** | NS ** | NS ** | NS ** | NS ** | - |
Sammenlignet med placebo, ble forbedring i glykemisk kontroll sett ved alle dosenivåer av Glucophage XR (metformin hydroklorid) Tabletter med utvidet frigivelse og behandling var ikke assosiert med noen vesentlig endring i vekt (se DOSERING OG ADMINISTRASJON for doseringsanbefalinger for Glucophage og Glucophage XR).
En 24-ukers, dobbeltblind, randomisert studie av Glucophage XR, tatt en gang daglig med kveldsmåltidet, og Glucophage (metformin hydrochloride) tabletter, tatt to ganger daglig (med frokost og kveldsmåltid), ble utført hos pasienter med diabetes type 2 som hadde blitt behandlet med Glucophage 500 mg to ganger daglig i minst 8 uker før studieinngangen. Glucophagedosen hadde ikke nødvendigvis blitt titrert for å oppnå et spesifikt nivå av glykemisk kontroll før studien ble påbegynt. Pasienter kvalifiserte seg for studien hvis HbA1c var 8,5% og FPG var â200 mg / dL. Endringer i glykemisk kontroll og kroppsvekt er vist i tabell 7.
Tabell 7: Sammendrag av gjennomsnittsendringer fra baseline * i HbA1c, Fastende plasmaglukose og kroppsvekt i uke 12 og ved endelig besøk (24-ukers studie)
| Glucophage 500 mg To ganger daglig |
Glucophage XR | ||
|---|---|---|---|
| 1000 mg En gang om dagen |
1500 mg En gang om dagen |
||
| * Alle pasienter på Glucophage 500 mg to ganger daglig ved baseline | |||
| en n = 68 | |||
| Hemoglobin A1c (%) | (N = 67) | (N = 72) | (N = 66) |
| Grunnlinje | 7.06 | 6.99 | 7.02 |
| Endre ved 12 uker | 0.14 | 0.23 | 0.04 |
| (95% CI) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| Endre ved ENDELIG BESØK | 0.14en | 0.27 | 0.13 |
| (95% CI) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dL) | (N = 69) | (N = 72) | (N = 70) |
| Grunnlinje | 127.2 | 131.0 | 131.4 |
| Endre ved 12 uker | 12.9 | 9.5 | 3.7 |
| (95% CI) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| Endre ved ENDELIG BESØK | 14.0 | 11.5 | 7.6 |
| (95% CI) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Kroppsvekt (kg) | (N = 71) | (N = 74) | (N = 71) |
| Grunnlinje | 210.3 | 202.8 | 192.7 |
| Endre ved 12 uker | 0.4 | 0.9 | 0.7 |
| (95% CI) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| Endre ved ENDELIG BESØK | 0.9 | 1.1 | 0.9 |
| (95% CI) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
Etter 12 ukers behandling var det en økning i gjennomsnittlig HbA1c i alle grupper; i gruppen Glucophage XR 1000 mg var økningen fra baseline på 0,23% statistisk signifikant (se DOSERING OG ADMINISTRASJON).
Endringer i lipidparametere i den tidligere beskrevne placebokontrollerte dose-responsstudien av Glucophage XR er vist i tabell 8.
Tabell 8: Sammendrag av gjennomsnittsprosentendringer fra baseline * i større lipidvariabler ved endelig besøk (16-ukers studie)
| Glucophage XR | placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg En gang Daglig |
1000 mg En gang Daglig |
1500 mg En gang Daglig |
2000 mg En gang Daglig |
1000 mg To ganger Daglig |
||
| * Alle pasienter på diettterapi ved baseline | ||||||
| Totalt kolesterol (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| Grunnlinje | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| Gjennomsnitt% endring ved ENDELIG BESØK | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Totalt triglyserider (mg / dL) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| Grunnlinje | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| Gjennomsnitt% endring ved ENDELIG BESØK | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| LDL-kolesterol (mg / dL) | (N = 119) | (N = 113) | (N = 109) | (N = 126) | (N = 117) | (N = 107) |
| Grunnlinje | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| Gjennomsnitt% endring ved ENDELIG BESØK | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| HDL-kolesterol (mg / dL) | (N = 120) | (N = 108) | (N = 108) | (N = 125) | (N = 117) | (N = 108) |
| Grunnlinje | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| Gjennomsnitt% endring ved ENDELIG BESØK | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
Endringer i lipidparametere i den tidligere beskrevne studien av Glucophage og Glucophage XR er vist i tabell 9.
Tabell 9: Sammendrag av gjennomsnittsprosentendringer fra baseline * i større lipidvariabler ved endelig besøk (24-ukers studie)
| Glucophage | Glucophage XR | ||
|---|---|---|---|
| 500 mg To ganger daglig |
1000 mg En gang om dagen |
1500 mg En gang om dagen |
|
| * Alle pasienter på Glucophage 500 mg to ganger daglig ved baseline | |||
| Totalt kolesterol (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Grunnlinje | 199.0 | 201.9 | 201.6 |
| Gjennomsnitt% endring ved ENDELIG BESØK | 0.1% | 1.3% | 0.1% |
| Totalt triglyserider (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Grunnlinje | 178.0 | 169.2 | 206.8 |
| Gjennomsnitt% endring ved ENDELIG BESØK | 6.3% | 25.3% | 33.4% |
| LDL-kolesterol (mg / dL) | (N = 68) | (N = 70) | (N = 66) |
| Grunnlinje | 122.1 | 126.2 | 115.7 |
| Gjennomsnitt% endring ved ENDELIG BESØK | −1.3% | −3.3% | −3.7% |
| HDL-kolesterol (mg / dL) | (N = 68) | (N = 70) | (N = 65) |
| Grunnlinje | 41.9 | 41.7 | 44.6 |
| Gjennomsnitt% endring ved ENDELIG BESØK | 4.8% | 1.0% | -2.1% |
Pediatriske kliniske studier
I en dobbeltblind, placebokontrollert studie hos barn i alderen 10 til 16 år med diabetes type 2 (gjennomsnittlig FPG 182,2 mg / dL), ble behandling med Glucophage (opp til 2000) mg / dag) i opptil 16 uker (gjennomsnittlig behandlingsvarighet 11 uker) resulterte i en betydelig gjennomsnittlig netto reduksjon i FPG på 64,3 mg / dL, sammenlignet med placebo (se tabell 10).
Tabell 10: Glucophage vs Placebo (Pediatricsen) Sammendrag av gjennomsnittlige endringer fra baseline * i plasma glukose og kroppsvekt ved endelig besøk
| Glucophage | placebo | p-verdi | |
|---|---|---|---|
| en Pediatriske pasienter betyr 13,8 år (intervallet 10-16 år) | |||
| * Alle pasienter på diettterapi ved baseline | |||
| ** Ikke statistisk signifikant | |||
| FPG (mg / dL) | (N = 37) | (N = 36) | |
| Grunnlinje Endre ved ENDELIG BESØK |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Kroppsvekt (kg) | (N = 39) | (N = 38) | |
| Grunnlinje Endre ved ENDELIG BESØK |
205.3 -3.3 |
189.0 -2.0 |
NS ** |
topp
Indikasjoner og bruk
Glucophage (metformin hydrochloride) tabletter er indikert som et supplement til kosthold og trening for å forbedre glykemisk kontroll hos voksne og barn med type 2 diabetes mellitus.
Glucophage XR (metformin hydrochloride) tabletter med utvidet frigivelse er indikert som et supplement til kosthold og trening for å forbedre glykemisk kontroll hos voksne med type 2 diabetes mellitus.
topp
Kontra
Glucophage og Glucophage XR er kontraindisert hos pasienter med:
Nyresykdom eller nedsatt funksjonsevne (f.eks. Som antydet av serumkreatininnivåer - 1,5 mg / dL [menn], 1,4 mg / dL [kvinner] eller unormal kreatininclearance) som også kan være resultat av tilstander som hjerte-kar-kollaps (sjokk), akutt hjerteinfarkt og septikemi (se ADVARSLER og FORHOLDSREGLER).
Kjent overfølsomhet for metforminhydroklorid.
Akutt eller kronisk metabolsk acidose, inkludert diabetisk ketoacidose, med eller uten koma. Diabetisk ketoacidose skal behandles med insulin.
Glucophage og Glucophage XR bør seponeres midlertidig hos pasienter som gjennomgår radiologiske studier som involverer intravaskulær administrering av joderte kontrastmaterialer, fordi bruk av slike produkter kan føre til akutt endring av nyrefunksjon. (Se også FORHOLDSREGLER.)
topp
advarsler
Melkesyre:
Melkesyreacidose er en sjelden, men alvorlig, metabolsk komplikasjon som kan oppstå på grunn av metforminakkumulering under behandling med Glucophage eller Glucophage XR; når det oppstår, er det dødelig i omtrent 50% av tilfellene. Melkesyreacidose kan også forekomme i forbindelse med en rekke patofysiologiske tilstander, inkludert diabetes mellitus, og når det er betydelig vevshypoperfusjon og hypoksemi. Melkesyreacidose er karakterisert ved forhøyede laktatnivåer i blodet (> 5 mmol / L), nedsatt pH-verdi i blodet, elektrolyttforstyrrelser med økt aniongap og økt laktat / pyruvatforhold. Når metformin er implisert som årsak til melkesyreadose, blir metforminplasmanivåer> 5 ug / ml generelt funnet.
Den rapporterte forekomsten av laktacidose hos pasienter som får metforminhydroklorid er veldig lav (omtrent 0,03 tilfeller / 1000 pasientår, med omtrent 0,015 dødsfall / 1000 pasient-år). I mer enn 20 000 pasientårs eksponering for metformin i kliniske studier, var det ingen rapporter om melkesyreose. Rapporterte tilfeller har hovedsakelig forekommet hos diabetespasienter med betydelig nyreinsuffisiens, inkludert begge iboende nyre sykdom og nyrehypoperfusjon, ofte ved innstilling av flere samtidige medisinske / kirurgiske problemer og flere samtidig medisiner. Pasienter med kongestiv hjertesvikt som krever farmakologisk behandling, spesielt pasienter med ustabil eller akutt kongestiv hjertesvikt som risikerer hypoperfusjon og hypoksemi, har økt risiko for laktikum acidose. Risikoen for laktacidose øker med graden av nedsatt funksjonsevne og pasientens alder. Risikoen for laktacidose kan derfor reduseres betydelig ved regelmessig overvåking av nyrefunksjonen i pasienter som tar Glucophage eller Glucophage XR og ved bruk av den minimale effektive dosen Glucophage eller Glucophage XR. Spesielt bør behandling av eldre ledsages av nøye overvåking av nyrefunksjonen. Glucophage eller Glucophage XR-behandling bør ikke startes hos pasienter på 80 år, med mindre måling av kreatinin clearance viser at nyrefunksjonen ikke er redusert, da disse pasientene er mer mottakelige for å utvikle melkesyre acidose. I tillegg bør Glucophage og Glucophage XR øyeblikkelig holdes tilbake i nærvær av en hvilken som helst tilstand som er assosiert med hypoksemi, dehydrering eller sepsis. Fordi nedsatt leverfunksjon betydelig kan begrense evnen til å fjerne laktat, glukofag og Glucophage XR bør vanligvis unngås hos pasienter med klinisk eller laboratoriebevis for lever sykdom. Pasienter bør varsles mot overdreven alkoholinntak, enten akutt eller kronisk, når de tar Glucophage eller Glucophage XR, siden alkohol styrker effekten av metforminhydroklorid på laktat metabolisme. I tillegg bør Glucophage og Glucophage XR midlertidig seponeres før noen intravaskulær radiokontrastundersøkelse og for enhver kirurgisk prosedyre (se også FORHOLDSREGLER).
Utbruddet av melkesyreose er ofte subtilt, og ledsages bare av ikke-spesifikke symptomer som ubehag, myalgi, luftveisproblemer, økende søvnighet og ikke-spesifikk magesyke. Det kan være assosiert hypotermi, hypotensjon og resistente bradyarytmier med mer markert acidose. Pasienten og pasientens lege må være klar over den mulige betydningen av slike symptomer, og pasienten skal instrueres til å varsle legen umiddelbart hvis de oppstår (se også FORHOLDSREGLER). Glucophage og Glucophage XR bør trekkes tilbake til situasjonen er avklart. Serumelektrolytter, ketoner, blodsukker, og hvis indikert, pH i blodet, laktatnivåer og til og med metforminnivåer i blodet kan være nyttige. Når en pasient er stabilisert på et hvilket som helst dose nivå av Glucophage eller Glucophage XR, er det lite sannsynlig at gastrointestinale symptomer, som er vanlige under igangsetting av terapi, er medikamentrelaterte. Senere forekomst av gastrointestinale symptomer kan skyldes melkesyre acidose eller annen alvorlig sykdom.
Nivåer for fastende venøs plasmalaktat over den øvre grensen for normal, men mindre enn 5 mmol / L, hos pasienter som tar Glucophage eller Glucophage XR, indikerer ikke nødvendigvis forestående laktacidose og kan forklares med andre mekanismer, for eksempel dårlig kontrollert diabetes eller overvekt, kraftig fysisk aktivitet eller tekniske problemer i prøven håndtering. (Se også FORHOLDSREGLER.)
Melkesyreacidose bør mistenkes hos enhver diabetisk pasient med metabolsk acidose som mangler bevis for ketoacidose (ketonuri og ketonemi).
Melkesyre acidose er en medisinsk nødsituasjon som må behandles på sykehus. Hos en pasient med melkesyreacidose som tar Glucophage eller Glucophage XR, bør legemidlet seponeres umiddelbart og generelle støttende tiltak øyeblikkelig settes i gang. Fordi metforminhydroklorid er dialyserbart (med en klarering på opptil 170 ml / min. Under god hemodynamisk forhold), anbefales hurtig hemodialyse for å korrigere acidosen og fjerne den akkumulerte metformin. Slik behandling resulterer ofte i hurtig reversering av symptomer og utvinning. (Se også KONTRA og FORHOLDSREGLER.)
topp
forholdsregler
Generell
Makrovaskulære utfall - Det har ikke vært noen kliniske studier som viser at det foreligger avgjørende bevis for reduksjon av makrovaskulær risiko med Glucophage eller Glucophage XR eller noe annet antidiabetisk middel.
Overvåking av nyrefunksjon - Metformin er kjent for å bli betydelig utskilt av nyrene og risikoen for akkumulering av metformin og melkesyre acidose øker med graden av nedsatt nyrefunksjon funksjon. Pasienter med serumkreatininnivåer som er over den øvre normalgrensen for deres alder, bør derfor ikke få Glucophage eller Glucophage XR. Hos pasienter med avansert alder, skal Glucophage og Glucophage XR nøye titreres for å etablere minimumsdosen for tilstrekkelig glykemisk effekt, fordi aldring er assosiert med redusert nyre funksjon. Hos eldre pasienter, særlig de som er 80 år, bør nyrefunksjonen overvåkes regelmessig, og generelt bør glukofag og glukofag XR ikke titreres til maksimal dose (se ADVARSLER og DOSERING OG ADMINISTRASJON).
Før igangsetting av Glucophage eller Glucophage XR-behandling og minst årlig etterpå, bør nyrefunksjonen vurderes og verifiseres som normal. Hos pasienter hvor det forventes utvikling av nyrefunksjon, bør nyrefunksjonen vurderes hyppigere og Glucophage eller Glucophage XR ble avsluttet hvis det er bevis på nedsatt nyrefunksjon tilstede.
Bruk av samtidig medisiner som kan påvirke nyrefunksjonen eller metformindisposisjonen - Samtidig medisinering som kan påvirke nyrefunksjonen eller føre til betydelig hemodynamisk endring eller kan forstyrre disposisjonen av metformin, for eksempel kationiske medisiner som elimineres ved renal tubulær sekresjon (se FORHOLDSREGLER: Legemiddelinteraksjoner), bør brukes med forsiktighet.
Radiologiske studier som involverer bruk av intravaskulære joderte kontrastmaterialer (for eksempel intravenøst urogram, intravenøst kolangiografi, angiografi og computertomografi (CT) skanninger med intravaskulære kontrastmaterialer) —Intravaskulære kontraststudier med joderte materialer kan føre til akutt endring av nyrefunksjonen og har blitt assosiert med melkesyreose hos pasienter som mottar metformin (se KONTRA). Derfor bør glukofag eller glukofag XR midlertidig seponeres på pasienter der en slik undersøkelse er planlagt. prosedyre, og holdes tilbake i 48 timer etter inngrepet og gjeninnført først etter at nyrefunksjonen er blitt evaluert på nytt og funnet å være vanlig.
Hypoksiske tilstander - kardiovaskulær kollaps (sjokk) fra uansett årsak, akutt kongestiv hjertesvikt, akutt hjerteinfarkt infarkt og andre forhold preget av hypoksemi har vært assosiert med melkesyre acidose og kan også forårsake prerenal azotemi. Når slike hendelser oppstår hos pasienter på Glucophage eller Glucophage XR-behandling, bør legemidlet omgående seponeres.
Kirurgiske inngrep — Glucophage eller Glucophage XR-behandling bør midlertidig stoppes for enhver kirurgisk prosedyre (bortsett fra mindre prosedyrer som ikke er tilknyttet med begrenset inntak av mat og væsker) og bør ikke startes på nytt før pasientens orale inntak har gjenopptatt og nyrefunksjonen er evaluert som vanlig.
Alkoholinntak - Det er kjent at alkohol styrker effekten av metformin på laktatmetabolismen. Pasienter bør derfor advares mot for høyt alkoholinntak, akutt eller kronisk, mens de får Glucophage eller Glucophage XR.
Nedsatt leverfunksjon - Siden nedsatt leverfunksjon har vært assosiert med noen tilfeller av melkesyre, Glucophage og Glucophage XR bør generelt unngås hos pasienter med klinisk eller laboratoriebevis for lever sykdom.
Vitamin B12-nivåer - I kontrollerte kliniske studier av Glucophage med 29 ukers varighet, er en reduksjon til subnormale nivåer av tidligere normale serum vitamin B12 nivåer, uten kliniske manifestasjoner, ble observert hos omtrent 7% av pasienter. En slik reduksjon, muligens på grunn av interferens med B12-absorpsjon fra B12-iboende faktorkomplekset, er imidlertid veldig sjelden assosiert med anemi og ser ut til å være raskt reversible ved seponering av Glucophage eller vitamin B12 kosttilskudd. Måling av hematologiske parametere på årsbasis anbefales hos pasienter på Glucophage eller Glucophage XR, og eventuelle tilsynelatende avvik bør undersøkes og håndteres på passende måte (se FORHOLDSREGLER: Laboratorietester).
Enkelte individer (de med utilstrekkelig vitamin B12 eller kalsiuminntak eller absorpsjon) ser ut til å være disponert for å utvikle subnormale vitamin B12 nivåer. Hos disse pasientene kan rutinemessige vitamin B12-målinger med 2- til 3-års intervaller være nyttige.
Endring i klinisk status hos pasienter med tidligere kontrollert diabetes type 2 - En pasient med diabetes type 2 som tidligere var godt kontrollert på Glucophage eller Glucophage XR som utvikler laboratorieavvik eller klinisk sykdom (spesielt vag og dårlig definert sykdom) bør vurderes omgående for bevis på ketoacidose eller laktisk acidose. Evalueringen bør omfatte serumelektrolytter og ketoner, blodsukker og, hvis indikert, blodets pH, laktat, pyruvat og metforminnivå. Hvis acidose av en eller annen form forekommer, må Glucophage eller Glucophage XR stoppes umiddelbart og andre passende korrigerende tiltak iverksettes (se også ADVARSLER).
Hypoglykemi - Hypoglykemi forekommer ikke hos pasienter som får Glucophage eller Glucophage XR alene under vanlige omstendigheter ved bruk, men kan oppstå når kaloriinntaket er mangelfull, når anstrengende trening ikke kompenseres ved kaloritilskudd, eller under samtidig bruk med andre glukosesenkende midler (som sulfonylurea og insulin) eller etanol.
Eldre, svekkede eller underernærte pasienter, og de med binyre- eller hypofyseinsuffisiens eller alkoholpåvirkning er spesielt utsatt for hypoglykemiske effekter. Hypoglykemi kan være vanskelig å gjenkjenne hos eldre, og hos personer som tar beta-adrenerge medisiner.
Tap av kontroll av blodsukker - Når en pasient som er stabilisert på et diabetesprogram blir utsatt for stress som feber, traumer, infeksjoner eller kirurgi, kan et midlertidig tap av glykemisk kontroll oppstå. På slike tidspunkt kan det være nødvendig å holde tilbake Glucophage eller Glucophage XR og midlertidig administrere insulin. Glucophage eller Glucophage XR kan gjeninnføres etter at den akutte episoden er løst.
Effektiviteten av orale antidiabetika til å senke blodsukkeret til et målnivå synker hos mange pasienter over en periode. Dette fenomenet, som kan skyldes progresjon av den underliggende sykdommen eller redusert reaksjonsevne for stoffet, er kjent som sekundær svikt, for å skille den fra primær svikt der medikamentet er ineffektivt under den første behandlingen. Skulle sekundær svikt oppstå med enten Glucophage eller Glucophage XR eller sulfonylurea monoterapi, kan kombinert behandling med Glucophage eller Glucophage XR og sulfonylurea resultere i et svar. Skulle sekundær svikt oppstå med kombinert Glucophage / sulfonylurea terapi eller Glucophage XR / sulfonylurea-terapi, kan det være nødvendig å vurdere terapeutiske alternativer inkludert initiering av insulinbehandling.
Informasjon til pasienter
Pasientene skal informeres om potensiell risiko og fordeler ved Glucophage eller Glucophage XR og om alternative behandlingsmåter. De bør også informeres om viktigheten av å overholde kostholdsinstruksjoner, for en regelmessig trening og regelmessig testing av blodsukker, glykosylert hemoglobin, nyrefunksjon og hematologisk parametre.
Risikoen for melkesyreose, symptomer og tilstander som disponerer for dens utvikling, som nevnt i ADVARSLER og FORHOLDSREGLER seksjoner, bør forklares for pasienter. Pasienter bør informeres om å avbryte Glucophage eller Glucophage XR øyeblikkelig og omgående varsle om deres helse utøver hvis uforklarlig hyperventilering, myalgi, ubehag, uvanlig søvnighet eller andre ikke-spesifikke symptomer skje. Når en pasient er stabilisert på et hvilket som helst dose nivå av Glucophage eller Glucophage XR, er det lite sannsynlig at gastrointestinale symptomer, som er vanlige under oppstart av metforminbehandling, er medikamentrelaterte. Senere forekomst av gastrointestinale symptomer kan skyldes melkesyre acidose eller annen alvorlig sykdom.
Pasienter bør rådes mot overdreven alkoholinntak, enten akutt eller kronisk, mens de får Glucophage eller Glucophage XR.
Glucophage eller Glucophage XR alene forårsaker vanligvis ikke hypoglykemi, selv om det kan oppstå når Glucophage eller Glucophage XR brukes sammen med orale sulfonylurea og insulin. Når du starter kombinasjonsbehandling, er risikoen for hypoglykemi, dens symptomer og behandling, og forhold som disponerer for dens utvikling, bør forklares for pasienter og ansvarlig familie medlemmer.
Pasientene skal informeres om at Glucophage XR må svelges hele og ikke knuses eller tygges, og at inaktive ingredienser kan av og til elimineres i avføringen som en myk masse som kan ligne originalen tablett.
Laboratorietester
Responsen på alle diabetiske behandlinger bør overvåkes ved periodiske målinger av fastende blod glukose og glykosylert hemoglobinnivå, med et mål om å redusere disse nivåene mot det normale område. Under initial dosetitrering kan faste glukose brukes til å bestemme den terapeutiske responsen. Deretter bør både glukose og glykosylert hemoglobin overvåkes. Målinger av glykosylert hemoglobin kan være spesielt nyttig for å evaluere langsiktig kontroll (se også DOSERING OG ADMINISTRASJON).
Innledende og periodisk overvåking av hematologiske parametere (f.eks. Hemoglobin / hematokrit og rødt blod) celleindekser) og nyrefunksjon (serumkreatinin) bør utføres, minst på årsbasis. Selv om megaloblasticanemia sjelden har blitt sett med Glucophage-terapi, hvis dette er mistenkt, bør vitamin B12-mangel utelukkes.
Legemiddelinteraksjoner (Klinisk evaluering av medikamentinteraksjoner utført med glukofag)
Glyburide - I en engangsstudie med interaksjon med diabetes type 2, samtidig administrering av metformin og glyburid resulterte ikke i noen endring i verken farmakokinetikk for metformin eller farmakodynamikk. Nedgang i glyburid AUC og Cmax ble observert, men var svært varierende. Enkeltdosens natur av denne studien og mangelen på sammenheng mellom glyburidblodnivå og farmakodynamiske effekter, gjør den kliniske betydningen av denne interaksjonen usikker (se DOSERING OG ADMINISTRASJON: Samtidig glukofag eller glukofag XR og oral sulfonylurea terapi hos voksne pasienter).
Furosemid - En enkeltdose, metformin-furosemid-interaksjonsstudie hos friske personer viste at farmakokinetiske parametere for begge forbindelsene var påvirket av samtidig administrering. Furosemid økte metforminplasmaet og Cmax i blodet med 22% og AUC i blodet med 15%, uten noen signifikant endring i renformen for metformin. Når administrert med metformin, var Cmax og AUC for furosemid henholdsvis 31% og 12% mindre enn når administrert alene, og den terminale halveringstiden ble redusert med 32%, uten noen signifikant endring i furosemid renal klarering. Ingen informasjon er tilgjengelig om interaksjonen mellom metformin og furosemid når den administreres sammen kronisk.
Nifedipin - En enkeltdosers, metformin-nifedipin medikamentinteraksjonsstudie hos normale friske frivillige demonstrerte at samtidig administrering av nifedipin økte plasma metformin Cmax og AUC med henholdsvis 20% og 9%, og økte mengden skilles ut i urinen. Tmax og halveringstid ble ikke påvirket. Nifedipin ser ut til å styrke absorpsjonen av metformin. Metformin hadde minimale effekter på nifedipin.
Kationiske medikamenter - Kationiske medikamenter (f.eks. Amilorid, digoksin, morfin, prokainamid, kinidin, kinin, ranitidin, triamteren, trimetoprim eller vankomycin) som elimineres ved renal tubulær sekresjon, teoretisk sett har potensialet for interaksjon med metformin ved å konkurrere om vanlig renal tubulær transport systemer. Slik interaksjon mellom metformin og oralt cimetidin er observert hos normale friske frivillige i både enkelt- og multidosemetformin-cimetidin. medikamentinteraksjonsstudier, med en 60% økning i topp metformin plasma og fullblodskonsentrasjoner og en 40% økning i plasma og fullblod metformin AUC. Det var ingen endring i eliminasjonshalveringstiden i endosestudien. Metformin hadde ingen effekt på farmakokinetikken til cimetidin. Selv om slike interaksjoner forblir teoretiske (bortsett fra cimetidin), må nøye pasientovervåking og dosejustering av Glucophage eller Glucophage XR og / eller det forstyrrende legemidlet anbefales hos pasienter som tar kationiske medisiner som skilles ut via den proksimale renale tubulære sekretor system.
Andre - Noen medikamenter har en tendens til å produsere hyperglykemi og kan føre til tap av glykemisk kontroll. Disse medisinene inkluderer tiazider og andre vanndrivende midler, kortikosteroider, fenotiaziner, skjoldbruskkjertelprodukter, østrogener, p-piller, fenytoin, nikotinsyre, sympatomimetika, kalsiumkanalblokkerende medisiner, og isoniazid. Når slike medisiner administreres til en pasient som får Glucophage eller Glucophage XR, bør pasienten følges nøye for tap av blodsukkerkontroll. Når slike medikamenter trekkes ut fra en pasient som får Glucophage eller Glucophage XR, bør pasienten følges nøye for hypoglykemi.
Hos friske frivillige ble ikke farmakokinetikken til metformin og propranolol og metformin og ibuprofen påvirket når den ble gitt samtidig i en-dose interaksjonsstudier.
Metformin er ubetydelig bundet til plasmaproteiner og er derfor mindre sannsynlig å interagere med sterkt proteinbundne medisiner som salisylater, sulfonamider, kloramfenikol og probenecid, sammenlignet med sulfonylurinstoffene, som i stor grad er bundet til serum proteiner.
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Langvarige kreftfremkallende studier er blitt utført på rotter (doseringsvarighet 104 uker) og mus (doseringsvarighet på 91 uker) i doser til og med 900 mg / kg / dag og 1500 mg / kg / dag, henholdsvis. Disse dosene er begge omtrent fire ganger den maksimale anbefalte menneskelige daglige dosen på 2000 mg basert på sammenligninger av kroppsoverflaten. Ingen bevis på kreftfremkallende egenskaper med metformin ble funnet hos hverken hann- eller hunnmus. Tilsvarende ble det ikke observert noe tumorigenisk potensiale med metformin hos hannrotter. Det var imidlertid en økt forekomst av godartede stromale livmor-polypper hos hunnrotter behandlet med 900 mg / kg / dag.
Det var ingen bevis for et mutagent potensial av metformin i følgende in vitro tester: Ames test (S. typhimurium), genmutasjonstest (lymfomceller fra mus) eller kromosomavvikstest (humane lymfocytter). Resultatene i in vivo-mikronukleustesten i mus var også negative.
Fruktbarhet av hann- eller hunnrotter ble ikke påvirket av metformin når de ble administrert i doser så høye som 600 mg / kg / dag, som er omtrent 3 ganger den maksimale anbefalte menneskelige daglige dosen basert på kroppsoverflaten sammenligninger.
Svangerskap
Teratogene effekter: Graviditet kategori B
Nyere informasjon antyder sterkt at unormale blodsukkernivåer under graviditet er assosiert med en høyere forekomst av medfødte avvik. De fleste eksperter anbefaler at insulin brukes under graviditet for å opprettholde blodsukkernivået så nær normalt som mulig. Siden reproduksjonsstudier av dyr ikke alltid er forutsi menneskelig respons, bør Glucophage og Glucophage XR ikke brukes under graviditet, med mindre det er nødvendig.
Det er ingen tilstrekkelige og godt kontrollerte studier på gravide med Glucophage eller Glucophage XR. Metformin var ikke teratogent hos rotter og kaniner i doser opp til 600 mg / kg / dag. Dette representerer en eksponering på omtrent 2 og 6 ganger den maksimale anbefalte humane daglige dosen på 2000 mg basert på kroppsoverflateareal sammenligninger for henholdsvis rotter og kaniner. Bestemmelse av fosterkonsentrasjoner demonstrerte en delvis placental barriere for metformin.
Sykepleiermødre
Studier på lakterende rotter viser at metformin skilles ut i melk og når nivåer som kan sammenlignes med nivåene i plasma. Lignende studier er ikke utført hos ammende mødre. Fordi potensialet for hypoglykemi hos ammende spedbarn kan eksistere, bør det tas en beslutning om det skal avbryte sykepleien eller å avbryte legemidlet under hensyntagen til stoffets betydning for medisinen mor. Hvis Glucophage eller Glucophage XR seponeres, og hvis kosthold alene ikke er tilstrekkelig til å kontrollere blodsukkeret, bør insulinbehandling vurderes.
Pediatrisk bruk
Sikkerheten og effektiviteten til Glucophage for behandling av diabetes type 2 er etablert i pediatriske pasienter i alderen 10 til 16 år (studier er ikke utført på barn under 10 år år). Bruk av Glucophage i denne aldersgruppen støttes av bevis fra adekvate og godt kontrollerte studier av Glucophage hos voksne med tilleggsdata fra en kontrollert klinisk studie hos barn i alderen 10 til 16 år med diabetes type 2, som viste en lignende respons i glykemisk kontroll som den som ble sett i voksne. (Se KLINISK FARMAKOLOGI: Pediatriske kliniske studier.) I denne studien var bivirkningene lik de som er beskrevet hos voksne. (Se BIVIRKNINGER: Pediatriske pasienter.) Det anbefales en maksimal daglig dose på 2000 mg. (Se DOSERING OG ADMINISTRASJON: Anbefalt doseringsplan: Barneleger.)
Sikkerhet og effektivitet av Glucophage XR hos barn er ikke fastslått.
Geriatrisk bruk
Kontrollerte kliniske studier av Glucophage og Glucophage XR inkluderte ikke tilstrekkelig antall eldre pasienter til å avgjøre om de responderer annerledes enn yngre pasienter, selv om annen rapportert klinisk erfaring ikke har identifisert forskjeller i svar mellom eldre og yngre pasienter. Metformin er kjent for å bli betydelig utskilt av nyrene, og fordi risikoen for alvorlige bivirkninger på stoffet er større hos pasienter med nedsatt nyrefunksjon, skal Glucophage og Glucophage XR bare brukes til pasienter med normal nyrefunksjon (se KONTRA, ADVARSLER, og KLINISK FARMAKOLOGI: Farmakokinetikk). Fordi aldring er assosiert med redusert nyrefunksjon, bør Glucophage eller Glucophage XR brukes med forsiktighet når alderen øker. Det bør utvises forsiktighet ved doseutvelgelse og bør være basert på nøye og regelmessig overvåking av nyrefunksjonen. Generelt sett bør ikke eldre pasienter titreres til maksimal dose Glucophage eller Glucophage XR (se også ADVARSLER og DOSERING OG ADMINISTRASJON).
topp
Bivirkninger
I en amerikansk dobbeltblind klinisk studie av Glucophage hos pasienter med diabetes type 2, fikk totalt 141 pasienter glukofagbehandling (opptil 2550 mg per dag) og 145 pasienter fikk placebo. Bivirkninger rapportert hos mer enn 5% av Glucophage-pasientene, og som var mer vanlig hos Glucophage- enn placebo-behandlede pasienter, er listet opp i tabell 11.
Tabell 11: Vanlige bivirkninger (> 5,0 prosent) i en placebokontrollert klinisk studie av glukofagmonoterapi *
| Bivirkning | Glucophage monoterapi (N = 141) |
placebo (N = 145) |
|---|---|---|
| % av pasientene | ||
| * Reaksjoner som var hyppigere hos pasienter behandlet med glukofage enn placebo. | ||
| Diaré | 53.2 | 11.7 |
| Kvalme oppkast | 25.5 | 8.3 |
| Flatulens | 12.1 | 5.5 |
| asteni | 9.2 | 5.5 |
| fordøyelsesproblemer | 7.1 | 4.1 |
| Ubehag i underlivet | 6.4 | 4.8 |
| Hodepine | 5.7 | 4.8 |
Diaré førte til seponering av studiemedisiner hos 6% av pasientene som ble behandlet med Glucophage. I tillegg ble følgende bivirkninger rapportert hos â € 1,0% til â € 5,0% av glukofagpasienter og ble hyppigere rapportert med Glucophage enn placebo: unormal avføring, hypoglykemi, myalgi, lethed, dyspné, neglelidelse, utslett, økt svette, smakssykdom, ubehag i brystet, frysninger, influensasyndrom, rødme, hjertebank.
I verdensomspennende kliniske studier har over 900 pasienter med diabetes type 2 blitt behandlet med Glucophage XR i placebo- og aktivt kontrollerte studier. I placebokontrollerte studier ble 781 pasienter gitt Glucophage XR og 195 pasienter fikk placebo. Bivirkninger rapportert hos mer enn 5% av Glucophage XR-pasientene, og som var mer vanlig hos Glucophage XR- enn placebo-behandlede pasienter, er listet opp i tabell 12.
Tabell 12: Vanlige bivirkninger (> 5,0 prosent) i placebokontrollerte studier av glukofag XR *
| Bivirkning | Glucophage XR (N = 781) |
placebo (N = 195) |
|---|---|---|
| % av pasientene | ||
| * Reaksjoner som var mer vanlig hos Glucophage XR- enn placebo-behandlede pasienter. | ||
| Diaré | 9.6 | 2.6 |
| Kvalme oppkast | 6.5 | 1.5 |
Diaré førte til seponering av studiemedisiner hos 0,6% av pasientene som ble behandlet med Glucophage XR. I tillegg ble følgende bivirkninger rapportert hos 1.0 1,0% til .0 ¤ 5,0% av Glucophage XR pasienter og ble hyppigere rapportert med Glucophage XR enn placebo: magesmerter, forstoppelse, distensjon i magen, dyspepsi / halsbrann, flatulens, svimmelhet, hodepine, øvre luftveisinfeksjon, smak forstyrrelse.
Pediatriske pasienter
I kliniske studier med Glucophage hos barn med diabetes type 2 var profilen til bivirkninger lik den som ble observert hos voksne.
topp
Overdose
Overdosering av metforminhydroklorid har skjedd, inkludert inntak av mengder større enn 50 gram. Hypoglykemi ble rapportert i omtrent 10% av tilfellene, men det er ikke påvist noen årsakssammenheng med metforminhydroklorid. Melkeacidose er rapportert i omtrent 32% av tilfeller av overdosering med metformin (se ADVARSLER). Metformin er dialyserbar med en klaring på opptil 170 ml / min under gode hemodynamiske forhold. Derfor kan hemodialyse være nyttig for fjerning av akkumulert medikament fra pasienter hvor mistanke om overdosering av metformin.
topp
Dosering og administrasjon
Det er ingen faste doseringsregimer for behandling av hyperglykemi hos pasienter med diabetes type 2 med Glucophage eller Glucophage XR eller noe annet farmakologisk middel. Dosering av Glucophage eller Glucophage XR må individualiseres på grunnlag av både effektivitet og toleranse, samtidig som den ikke overskrider de anbefalte daglige dosene. Den maksimale anbefalte daglige dosen Glucophage er 2550 mg hos voksne og 2000 mg hos barn (10-16 år); den maksimale anbefalte daglige dosen Glucophage XR hos voksne er 2000 mg.
Glucophage bør gis i delte doser med måltider, mens Glucophage XR generelt bør gis en gang daglig med kveldsmåltidet. Glucophage eller Glucophage XR bør startes i en lav dose, med gradvis opptrapping av dosen, begge for å redusere gastrointestinale bivirkninger og for å tillate identifikasjon av minimumsdosen som kreves for adekvat glykemisk kontroll av pasienten.
Under behandlingsstart og dosetitrering (se anbefalt doseringsskjema nedenfor), bør fastende plasmaglukose være brukes til å bestemme den terapeutiske responsen på Glucophage eller Glucophage XR og identifisere den minimale effektive dosen for tålmodig. Deretter skal glykosylert hemoglobin måles med intervaller på omtrent 3 måneder. Det terapeutiske målet bør være å redusere både fastende plasmaglukose og glykosylert hemoglobinnivå til normalt eller nær normalt ved ved å bruke den laveste effektive dosen Glucophage eller Glucophage XR, enten når den brukes som monoterapi eller i kombinasjon med sulfonylurea eller insulin.
Overvåking av blodsukker og glykosylert hemoglobin vil også tillate påvisning av primær svikt, dvs. utilstrekkelig senking av blodsukker ved maksimal anbefalt dose medisiner og sekundær svikt, dvs. tap av tilstrekkelig respons på blodsukker etter en innledende periode på effektivitet.
Kortvarig administrering av Glucophage eller Glucophage XR kan være tilstrekkelig i perioder med kortvarig tap av kontroll hos pasienter som vanligvis er godt kontrollert på diett alene.
Glucophage XR tabletter må svelges hele og aldri knuses eller tygges. Noen ganger vil de inaktive ingrediensene i Glucophage XR bli eliminert i avføringen som en myk, hydrert masse.
Anbefalt doseringsplan
Voksne
Generelt sett er ikke klinisk signifikante responser i doser under 1500 mg per dag. Imidlertid anbefales en lavere anbefalt startdose og gradvis økt dosering for å minimere gastrointestinale symptomer.
Den vanlige startdosen Glucophage (metformin hydrochloride) tabletter er 500 mg to ganger om dagen eller 850 mg en gang om dagen, gitt med måltider. Doseringsøkninger bør gjøres i trinn på 500 mg hver uke eller 850 mg hver 2. uke, opp til totalt 2000 mg per dag, gitt i oppdelte doser. Pasienter kan også titreres fra 500 mg to ganger om dagen til 850 mg to ganger om dagen etter 2 uker. For de pasienter som trenger ytterligere glykemisk kontroll, kan Glucophage gis til en maksimal daglig dose på 2550 mg per dag. Doser over 2000 mg kan tolereres bedre gitt 3 ganger om dagen med måltider.
Den vanlige startdosen av Glucophage XR (metformin hydrochloride) utvidede frigivelsestabletter er 500 mg en gang daglig med kveldsmåltidet. Doseringsøkninger bør gjøres i trinn på 500 mg ukentlig, opp til maksimalt 2000 mg en gang daglig med kveldsmåltidet. Hvis glykemisk kontroll ikke oppnås på Glucophage XR 2000 mg en gang daglig, bør en studie av Glucophage XR 1000 mg to ganger daglig vurderes. Hvis høyere doser metformin er nødvendig, bør Glucophage brukes i totale daglige doser opptil 2550 mg administrert i delte daglige doser, som beskrevet ovenfor. (Se KLINISK FARMAKOLOGI: Kliniske studier.)
I en randomisert studie ble pasienter som for øyeblikket ble behandlet med Glucophage byttet til Glucophage XR. Resultatene fra denne studien antyder at pasienter som får Glucophage-behandling trygt kan byttes til Glucophage XR en gang daglig med samme totale daglige dose, opp til 2000 mg en gang daglig. Etter en bytte fra Glucophage til Glucophage XR, bør glykemisk kontroll overvåkes nøye og dosejustering gjøres i samsvar med dette (se KLINISK FARMAKOLOGI: Kliniske studier).
Pediatrics
Den vanlige startdosen Glucophage er 500 mg to ganger om dagen, gitt med måltider. Doseringsøkninger bør gjøres i trinn på 500 mg ukentlig opp til maksimalt 2000 mg per dag, gitt i oppdelte doser. Sikkerhet og effektivitet av Glucophage XR hos barn er ikke fastslått.
Overføring fra annen antidiabetisk terapi
Ved overføring av pasienter fra andre orale hypoglykemiske midler enn klorpropamid til Glucophage eller Glucophage XR, er det vanligvis ikke nødvendig med noen overgangsperiode. Ved overføring av pasienter fra klorpropamid, bør forsiktighet utvises i løpet av de første 2 ukene på grunn av langvarig retensjon av klorpropamid i kroppen, noe som fører til overlappende medikamentelle effekter og mulig hypoglykemi.
Samtidig glukofag eller glukofag XR og oral sulfonylurea terapi hos voksne pasienter
Hvis pasienter ikke har svart på 4 uker med maksimal dose Glucophage eller Glucophage XR monoterapi, bør det vurderes gradvis tilsetning av en oral sulfonylurea mens du fortsetter Glucophage eller Glucophage XR i maksimal dose, selv om tidligere primær eller sekundær svikt i en sulfonylurea har inntraff. Kliniske og farmakokinetiske legemiddelinteraksjonsdata er foreløpig bare tilgjengelige for metformin pluss glyburid (glibenklamid).
Med samtidig Glucophage eller Glucophage XR og sulfonylurea terapi, kan ønsket kontroll av blodsukker oppnås ved å justere dosen for hvert medikament. I en klinisk studie med pasienter med diabetes type 2 og tidligere svikt på glyburid, ble pasienter startet med Glucophage 500 mg og 20 mg glyburide titrert til 1000/20 mg, 1500/20 mg, 2000/20 mg eller henholdsvis 2500/20 mg Glucophage og glyburid for å nå målet om glykemisk kontroll målt ved FPG, HbA1c og plasmaglukoserespons (se KLINISK FARMAKOLOGI: Kliniske studier). Imidlertid bør man prøve å identifisere den minimale effektive dosen av hvert medikament for å oppnå dette målet. Ved samtidig Glucophage eller Glucophage XR og sulfonylurea terapi fortsetter risikoen for hypoglykemi assosiert med sulfonylurea terapi og kan økes. Passende forholdsregler bør tas. (Se pakningsvedlegg til respektive sulfonylurea.)
Hvis pasienter ikke har svart tilfredsstillende 1 til 3 måneders samtidig behandling med maksimal dose Glucophage eller Glucophage XR og maksimal dose av en oral sulfonylurea, bør du vurdere terapeutiske alternativer, inkludert bytte til insulin med eller uten Glucophage eller Glucophage XR.
Samtidig glukofasje eller glukofag XR og insulinbehandling hos voksne pasienter
Gjeldende insulindose bør fortsettes etter oppstart av Glucophage eller Glucophage XR-behandling. Glucophage eller Glucophage XR-behandling bør startes med 500 mg en gang daglig hos pasienter som får insulinbehandling. For pasienter som ikke svarer tilstrekkelig, bør dosen Glucophage eller Glucophage XR økes med 500 mg etter omtrent 1 uke og med 500 mg hver uke deretter til det er tilstrekkelig glykemisk kontroll oppnådd. Maksimal anbefalt daglig dose er 2500 mg for Glucophage og 2000 mg for Glucophage XR. Det anbefales at insulindosen reduseres med 10% til 25% ved fastende plasmaglukose konsentrasjonene reduseres til under 120 mg / dL hos pasienter som får samtidig insulin og Glucophage eller Glucophage XR. Ytterligere justering bør individualiseres basert på glukosesenkende respons.
Spesifikke pasientpopulasjoner
Glucophage eller Glucophage XR anbefales ikke til bruk under graviditet. Glukofag anbefales ikke hos pasienter under 10 år. Glucophage XR anbefales ikke til barn (under 17 år).
Innledende og vedlikeholdsdosering av Glucophage eller Glucophage XR bør være konservativ hos pasienter med avansert alder, på grunn av potensialet for nedsatt nyrefunksjon i denne populasjonen. Enhver dosejustering bør baseres på en nøye vurdering av nyrefunksjonen. Generelt bør ikke eldre, svekkede og underernærte pasienter titreres til maksimal dose Glucophage eller Glucophage XR.
Overvåkning av nyrefunksjon er nødvendig for å hjelpe til med å forhindre melkesyreose, spesielt hos eldre. (Se ADVARSLER.)
topp
Hvordan leveres
Glucophage® (metformin hydrochloride) tabletter
| 500 mg | Flasker på 100 | NDC 0087-6060-05 |
| 500 mg | Flasker på 500 | NDC 0087-6060-10 |
| 850 mg | Flasker på 100 | NDC 0087-6070-05 |
| 1000 mg | Flasker på 100 | NDC 0087-6071-11 |
Glucophage 500 mg tabletter er runde, hvite til off-white, filmdrasjerte tabletter merket med "BMS 6060 "rundt periferien til nettbrettet på den ene siden og" 500 "preget over ansiktet til den andre side.
Glucophage 850 mg tabletter er runde, hvite til off-white, filmdrasjerte tabletter merket med "BMS 6070 "rundt periferien til nettbrettet på den ene siden og" 850 "preget over ansiktet til den andre side.
Glucophage 1000 mg tabletter er hvite, ovale, bikonvekse, filmdrasjerte tabletter med "BMS 6071" preget på den ene siden og "1000" preget på motsatt side og med en halvline på begge sider.
Glucophage® XR (metformin hydrochloride) tabletter med utvidet utgivelse
| 500 mg | Flasker på 100 | NDC 0087-6063-13 |
| 750 mg | Flasker på 100 | NDC 0087-6064-13 |
Glucophage XR 500 mg tabletter er hvite til off-white, kapselformede, bikonvekse tabletter, med "BMS 6063" preget på den ene siden og "500" preget over ansiktet på den andre siden.
Glucophage XR 750 mg tabletter er kapselformede, bikonvekse tabletter, med "BMS 6064" preget på den ene siden og "750" preget på den andre siden. Tablettene er lyserøde og kan ha en flekkete utseende.
Oppbevaring
Oppbevares ved 20-25 ° C; utflukter tillatt til 15-30 ° C. [Se USP-kontrollert romtemperatur.]
Dispenser i lysresistente beholdere.
Glucophage® er et registrert varemerke for Merck Santà © S.A.S., tilknyttet Merck KGaA i Darmstadt, Tyskland. Lisensiert til Bristol-Myers Squibb Company.
Distribuert av:
Bristol-Myers Squibb Company
Princeton, NJ 08543 USA
siste oppdatering: 01/2009
Glukohage, metforminhydroklorid, pasientinformasjon (på vanlig engelsk)
Detaljert informasjon om tegn, symptomer, årsaker, behandling av diabetes
Informasjonen i denne monografien er ikke ment å dekke all mulig bruk, anvisninger, forsiktighetsregler, medikamentinteraksjoner eller uheldige effekter. Denne informasjonen er generalisert og er ikke ment som spesifikk medisinsk råd. Hvis du har spørsmål om medisinene du tar eller ønsker mer informasjon, bør du kontakte lege, apotek eller sykepleier.
tilbake til: Bla gjennom alle medisiner for diabetes



