Actos for type 2 diabetes
Merkenavn: Actos
Generisk navn: Pioglitazone hydroklorid
Innhold:
Beskrivelse
farmakologi
Indikasjoner og bruk
Kontra
advarsler
forholdsregler
Bivirkninger
Overdose
Dosering og administrasjon
Hvordan leveres
Actos, pioglitazone hcl, pasientinformasjon (på vanlig engelsk)
ADVARSEL: KONFESTIV HJERTESVIKLING
- Thiazolidinediones, inkludert Actos, forårsaker eller forverrer kongestiv hjertesvikt hos noen pasienter (se ADVARSLER). Etter igangsetting av Actos, og etter økning av dosen, observer pasienter nøye for tegn og symptomer på hjertesvikt (inkludert overdreven, rask vektøkning, dyspné og / eller ødem). Hvis disse tegnene og symptomene utvikler seg, bør hjertesvikt håndteres i henhold til gjeldende standarder for omsorg. Videre må seponering eller dosereduksjon av Actos vurderes.
- Actos anbefales ikke til pasienter med symptomatisk hjertesvikt. Initiering av Actos hos pasienter med etablert NYHA klasse III eller IV hjertesvikt er kontraindisert (se KONTRA og ADVARSLER).
Beskrivelse
Actos (pioglitazon hydrochloride) er et oralt antidiabetisk middel som virker primært ved å redusere insulinresistensen. Actos brukes i behandling av type 2 diabetes mellitus (også kjent som ikke-insulinavhengig diabetes mellitus [NIDDM] eller voksendebut diabetes). Farmakologiske studier indikerer at Actos forbedrer følsomheten for insulin i muskel- og fettvev og hemmer glukoneogenesen i leveren. Actos forbedrer glykemisk kontroll og reduserer sirkulerende insulinnivåer.
Pioglitazon [(±) -5 - [[4- [2- (5-etyl-2-pyridinyl) etoksy] fenyl] metyl] -2,4-] tiazolidindionmonohydroklorid tilhører en annen kjemisk klasse og har en annen farmakologisk virkning enn sulfonylurinstoffene, metformin eller Î ± -glukosidasen inhibitorer. Molekylet inneholder ett asymmetrisk karbon, og forbindelsen syntetiseres og brukes som den racemiske blandingen. De to enantiomerene av pioglitazon interkonverterer in vivo. Det ble ikke funnet noen forskjeller i den farmakologiske aktiviteten mellom de to enantiomerene. Strukturformelen er som vist:
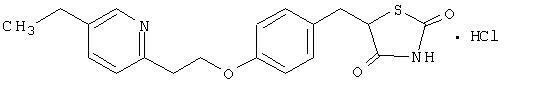
Pioglitazone hydrochloride er et luktfritt hvitt krystallinsk pulver som har en molekylformel C19H20N2O3S-HCl og en molekylvekt på 392,90 dalton. Det er oppløselig i N, N-dimetylformamid, svakt løselig i vannfri etanol, veldig lett oppløselig i aceton og acetonitril, praktisk talt uoppløselig i vann og uoppløselig i eter.
Actos er tilgjengelig som en tablett for oral administrering som inneholder 15 mg, 30 mg eller 45 mg pioglitazon (som base) formulert med følgende hjelpestoffer: lAktosemonohydrat NF, hydroksypropylcellulose NF, karboksymetylcellulosekalsium NF og magnesiumstearat NF.
topp
Klinisk farmakologi
Virkningsmekanismen
Actos er et antidiabetisk middel mot tiazolidindion som avhenger av tilstedeværelsen av insulin for dens virkningsmekanisme. Actos reduserer insulinresistensen i periferien og i leveren, noe som resulterer i økt insulinavhengig glukoseavfall og redusert lever glukose. I motsetning til sulfonylurinstoffer, er pioglitazon ikke en insulinsekretagog. Pioglitazon er en kraftig agonist for peroksisomproliferator-aktivert reseptor-gamma (PPARγ). PPAR-reseptorer finnes i vev som er viktige for insulinvirkning som fettvev, skjelettmuskel og lever. Aktivering av kjernefysiske reseptorer med PPARγ modulerer transkripsjonen av et antall insulin-responsive gener involvert i kontrollen av glukose og lipidmetabolisme.
I dyremodeller av diabetes reduserer pioglitazon hyperglykemi, hyperinsulinemi og hypertriglyseridemi som er karakteristisk for insulinresistente tilstander som diabetes type 2. De metabolske forandringene produsert av pioglitazon resulterer i økt responsivitet av insulinavhengig vev og blir observert i en rekke dyremodeller av insulinresistens.
Siden pioglitazon forbedrer effekten av sirkulerende insulin (ved å redusere insulinresistens), senker det ikke blodsukkeret i dyremodeller som mangler endogent insulin.
Farmakokinetikk og stoffskifte
Serumkonsentrasjonen av total pioglitazon (pioglitazon pluss aktive metabolitter) forblir forhøyet 24 timer etter dosering en gang daglig. Serumkonsentrasjoner av jevn tilstand av både pioglitazon og total pioglitazon oppnås innen 7 dager. Ved jevn tilstand når to av de farmakologisk aktive metabolitter av pioglitazon, Metabolites III (M-III) og IV (M-IV), serumkonsentrasjoner som er lik eller større enn pioglitazon. Både friske frivillige og hos pasienter med diabetes type 2, utgjør pioglitazon omtrent 30 til 50% av topp totale pioglitazon serumkonsentrasjoner og 20% til 25% av det totale arealet under serumkonsentrasjon-tidskurven (AUC).
Maksimal serumkonsentrasjon (Cmax), AUC og gjennomgang av serumkonsentrasjoner (Cmin) for både pioglitazon og total pioglitazon øker proporsjonalt i doser på 15 mg og 30 mg per dag. Det er en litt mindre enn proporsjonal økning for pioglitazon og total pioglitazon i en dose på 60 mg per dag.
Absorpsjon: Etter oral administrering, i fastende tilstand, er pioglitazon først målbar i serum innen 30 minutter, med topp konsentrasjoner observert innen 2 timer. Mat forsinker litt tid til å maksimere serumkonsentrasjonen til 3 til 4 timer, men endrer ikke absorpsjonsgraden.
Distribusjon: Det gjennomsnittlige tilsynelatende distribusjonsvolumet (Vd / F) av pioglitazon etter administrering av en enkelt dose er 0,63 ± 0,41 (gjennomsnitt ± SD) L / kg kroppsvekt.
Pioglitazon er i stor grad proteinbundet (> 99%) i humant serum, hovedsakelig til serumalbumin. Pioglitazon binder seg også til andre serumproteiner, men med lavere affinitet. Metabolitter M-III og M-IV er også i utstrakt grad bundet (> 98%) til serumalbumin.
Metabolisme: Pioglitazon metaboliseres mye ved hydroksylering og oksidasjon; metabolittene konverterer også delvis til glukuronid- eller sulfatkonjugater. Metabolitter M-II og M-IV (hydroksy-derivater av pioglitazon) og M-III (keto-derivat av pioglitazon) er farmakologisk aktive i dyremodeller av type 2-diabetes. I tillegg til pioglitazon er M-III og M-IV de viktigste medisinrelaterte artene som finnes i humant serum etter multidosering. Ved jevn tilstand, både friske frivillige og hos pasienter med diabetes type 2, pioglitazon omfatter omtrent 30% til 50% av de totale toppserumkonsentrasjonene og 20% til 25% av mengden total AUC.
In vitro-data viser at flere CYP-isoformer er involvert i metabolismen av pioglitazon. De involverte cytokrom P450-isoformene er CYP2C8 og i mindre grad CYP3A4 med ytterligere bidrag fra en rekke andre isoformer inkludert den hovedsakelig ekstrahepatiske CYP1A1. In vivo studier av pioglitazon i kombinasjon med P450-hemmere og underlag er utført (se Narkotikahandel). Urinære 6Ã-hydroksykortisol / kortisolforhold målt hos pasienter behandlet med Actos viste at pioglitazon ikke er en sterk CYP3A4 enzymindusor.
Utskillelse og eliminering: Etter oral administrering gjenvinnes omtrent 15% til 30% av pioglitazondosen i urinen. Eliminering av pioglitazon er ubetydelig, og stoffet skilles ut først og fremst som metabolitter og deres konjugater. Det antas at mesteparten av den orale dosen skilles ut i gallen enten uendret eller som metabolitter og elimineres i avføring.
Gjennomsnittlig serumhalveringstid for pioglitazon og total pioglitazon varierer fra henholdsvis 3 til 7 timer og 16 til 24 timer. Pioglitazon har en tilsynelatende klarering, CL / F, beregnet til å være 5 til 7 l / time.
Spesielle befolkninger
Nedsatt nyrefunksjon: Halveringstiden for eliminering av serum for pioglitazon, M-III og M-IV forblir uendret hos pasienter med moderat (kreatininclearance 30 til 60 ml / min) til alvorlig (kreatininclearance <30 ml / min) nedsatt nyrefunksjon sammenlignet med normalt fag. Ingen dosejustering anbefales hos pasienter med nedsatt nyrefunksjon (se DOSERING OG ADMINISTRASJON).
Nedsatt leverfunksjon: Sammenlignet med normale kontroller har personer med nedsatt leverfunksjon (Child-Pugh Grade B / C) en tilnærmet 45% reduksjon i pioglitazon og total pioglitazon betyr gjennomsnittlige toppkonsentrasjoner, men ingen endring i gjennomsnittlig AUC verdier.
Actos-behandling bør ikke startes hvis pasienten viser klinisk bevis på aktiv leversykdom eller serumtransaminasinnivå (ALT) overskrider 2,5 ganger den øvre normalgrensen (se FORHOLDSREGLER, Levereffekter).
Eldre: Hos friske eldre individer er maksimale serumkonsentrasjoner av pioglitazon og total pioglitazon ikke signifikant forskjellige, men AUC-verdiene er litt høyere og de terminale halveringstidene litt lenger enn for yngre fag. Disse endringene var ikke av en størrelse som ville bli ansett som klinisk relevante.
Pediatri: Farmakokinetiske data for barn er ikke tilgjengelig.
Kjønn: Den gjennomsnittlige Cmax og AUC-verdiene ble økt 20% til 60% hos kvinner. Som monoterapi og i kombinasjon med sulfonylurea, metformin eller insulin, forbedret Actos glykemisk kontroll hos både menn og kvinner. I kontrollerte kliniske studier, hemoglobin A1c (HbA1c) reduksjoner fra baseline var generelt større for kvinner enn for menn (gjennomsnittlig gjennomsnittlig forskjell i HbA1c 0.5%). Siden behandlingen bør individualiseres for hver pasient for å oppnå glykemisk kontroll, anbefales ingen dosejustering basert på kjønn alene.
Etnisitet: Farmakokinetiske data mellom ulike etniske grupper er ikke tilgjengelige.
Legemiddelinteraksjoner
Følgende medisiner ble studert hos friske frivillige med en samtidig administrering av Actos 45 mg en gang daglig. Resultatene nedenfor er listet nedenfor:
Orale prevensjonsmidler: Samtidig administrering av Actos (45 mg en gang daglig) og et oralt prevensjonsmiddel (1 mg norethindrone pluss 0,035 mg etinyløstradiol en gang daglig) i 21 dager, resulterte i 11% og 11-14% reduksjon i etinyløstradiol AUC (0-24 timer) og Cmax henholdsvis. Det var ingen signifikante forandringer i norethindrone AUC (0-24 timer) og Cmax. Med tanke på den høye variasjonen i farmakokinetikk for etinyløstradiol, er den kliniske betydningen av dette funnet ukjent.
Fexofenadin HCl: Samtidig administrering av Actos i 7 dager med 60 mg fexofenadin administrert oralt to ganger daglig ga ingen signifikant effekt på farmakokinetikken til pioglitazon. Actos hadde ingen signifikant effekt på farmakokinetikken for fexofenadin.
Glipizide: Samtidig administrering av Actos og 5 mg glipizid administrert oralt en gang daglig i 7 dager forandret ikke farmakokinetikken til glipizid ved stabil tilstand.
Digoksin: Samtidig administrering av Actos med 0,25 mg digoksin administrert oralt en gang daglig i 7 dager forandret ikke farmakokinetikken til digoxin ved stabil tilstand.
Warfarin: Samtidig administrering av Actos i 7 dager med warfarin forandret ikke farmakokinetikken til warfarin ved stabil tilstand. Actos har ingen klinisk signifikant effekt på protrombintiden når den gis til pasienter som får kronisk warfarinbehandling.
Metformin: Samtidig administrering av en enkelt dose metformin (1000 mg) og Actos etter 7 dager med Actos forandret ikke farmakokinetikken til enkeltdosen metformin.
Midazolam: Administrering av Actos i 15 dager etterfulgt av en enkelt 7,5 mg dose av midazolam sirup resulterte i en reduksjon på 26% i midazolam Cmax og AUC.
Ranitidine HCl: Samtidig administrering av Actos i 7 dager med ranitidin administrert oralt to ganger daglig i enten 4 eller 7 dager resulterte i ingen signifikant effekt på farmakokinetikken til pioglitazon. Actos viste ingen signifikant effekt på farmakokinetikken til ranitidin.
Nifedipin ER: Samtidig administrering av Actos i 7 dager med 30 mg nifedipin ER administrert oralt en gang daglig i 4 dager til mannlige og kvinnelige frivillige resulterte i minst kvadratiske middelverdier (90% CI) for uendret nifedipin på 0,83 (0,73 - 0,95) for Cmax og 0,88 (0,80 - 0,96) for AUC. Med tanke på den høye variasjonen i nifedipin farmakokinetikk, er den kliniske betydningen av dette funnet ukjent.
Ketoconazol: Samtidig administrering av Actos i 7 dager med ketoconazol 200 mg administrert to ganger daglig resulterte i minst kvadratiske middelverdier (90% CI) for uendret pioglitazon på 1,14 (1,06 - 1,23) for Cmax1,34 (1,26 - 1,41) for AUC og 1,87 (1,71 - 2,04) for Cmin.
Atorvastatin kalsium: Samtidig administrering av Actos i 7 dager med atorvastatin kalsium (LIPITOR®) 80 mg en gang daglig resulterte i minst kvadratiske middelverdier (90% CI) for uendret pioglitazon på 0,69 (0,57 - 0,85) for Cmax0,76 (0,65 - 0,88) for AUC og 0,96 (0,87 - 1,05) for Cmin. For uendret atorvastatin var de minste kvadratiske middelverdiene (90% CI) verdier 0,77 (0,66 - 0,90) for Cmax0,86 (0,78 - 0,94) for AUC og 0,92 (0,82 - 1,02) for Cmin.
Teofyllin: Samtidig administrering av Actos i 7 dager med teofyllin 400 mg administrert to ganger daglig resulterte i ingen endring i farmakokinetikken til noen av medikamentene.
Cytokrom P450: Se FORHOLDSREGLER
Gemfibrozil: Samtidig administrering av gemfibrozil (oral 600 mg to ganger daglig), en hemmer av CYP2C8, med pioglitazon (oral 30 mg) hos 10 friske frivillige forhåndsbehandlede i 2 dager før med gemfibrozil (oral mg 600 mg to ganger daglig) resulterte i at pioglitazoneksponering (AUC0-24) var 226% av eksponering for pioglitazon i fravær av gemfibrozil (se FORHOLDSREGLER).
Rifampin: Samtidig administrering av rifampin (oral mg 600 mg en gang daglig), en inducer av CYP2C8 og pioglitazon (oral oral mg) hos 10 friske frivillige forhåndsbehandlet i 5 dager før med rifampin (oralt 600 mg en gang daglig) resulterte i en reduksjon i AUC for pioglitazon med 54% (se FORHOLDSREGLER).
Farmakodynamikk og kliniske effekter
Kliniske studier viser at Actos forbedrer insulinfølsomheten hos insulinresistente pasienter. Actos forbedrer cellulær respons på insulin, øker insulinavhengig glukoseavfall, forbedrer leverfølsomheten for insulin og forbedrer dysfunksjonell glukosehomeostase. Hos pasienter med type 2-diabetes resulterer den reduserte insulinresistensen produsert av Actos i lavere plasmaglukosekonsentrasjoner, lavere plasmanivåinsulinnivå og lavere HbA1c verdier. Basert på resultater fra en åpen utvidelsesstudie ser det ut til at glukosesenkende effekter av Actos vedvarer i minst ett år. I kontrollerte kliniske studier hadde Actos i kombinasjon med sulfonylurea, metformin eller insulin en additiv effekt på glykemisk kontroll.
Pasienter med lipidavvik ble inkludert i kliniske studier med Actos. Totalt sett hadde pasienter behandlet med Actos gjennomsnittlig reduksjon i triglyserider, gjennomsnittlig økning i HDL-kolesterol, og ingen konsistente gjennomsnittlige endringer i LDL og totalt kolesterol.
I en 26-ukers, placebokontrollert, dose-varierende studie, falt gjennomsnittlig triglyseridnivå i 15 mg, 30 mg og 45 mg Actos dosegrupper sammenlignet med en gjennomsnittlig økning i placebogruppen. Gjennomsnittlig HDL-nivå økte i større grad hos pasienter behandlet med Actos enn hos placebo-behandlede pasienter. Det var ingen konsistente forskjeller for LDL og totalt kolesterol hos pasienter behandlet med Actos sammenlignet med placebo (tabell 1).
Tabell 1 Lipider i en 26-ukers placebokontrollert doserammende studie med monoterapi
| placebo | Actos 15 mg En gang Daglig |
Actos 30 mg En gang Daglig |
Actos 45 mg En gang Daglig |
|
| Triglyserider (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Baseline (gjennomsnitt) | 262.8 | 283.8 | 261.1 | 259.7 |
| Prosentvis endring fra grunnlinjen (gjennomsnitt) | 4.8% | -9.0% | -9.6% | -9.3% |
| HDL-kolesterol (mg / dL) | N = 79 | N = 79 | N = 83 | N = 77 |
| Baseline (gjennomsnitt) | 41.7 | 40.4 | 40.8 | 40.7 |
| Prosentvis endring fra grunnlinjen (gjennomsnitt) | 8.1% | 14.1% | 12.2% | 19.1% |
| LDL-kolesterol (mg / dL) | N = 65 | N = 63 | N = 74 | N = 62 |
| Baseline (gjennomsnitt) | 138.8 | 131.9 | 135.6 | 126.8 |
| Prosentvis endring fra grunnlinjen (gjennomsnitt) | 4.8% | 7.2% | 5.2% | 6.0% |
| Totalt kolesterol (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Baseline (gjennomsnitt) | 224.6 | 220.0 | 222.7 | 213.7 |
| Prosentvis endring fra grunnlinjen (gjennomsnitt) | 4.4% | 4.6% | 3.3% | 6.4% |
I de to andre monoterapistudiene (24 uker og 16 uker) og i kombinasjonsbehandlingsstudier med sulfonylurea (24 uker og 16 uker) og metformin (24 uker og 16 uker), var resultatene generelt i samsvar med dataene ovenfor. I placebokontrollerte studier, reduserte de placebokorrigerte gjennomsnittlige endringene fra baseline 5% til 26% for triglyserider og økte 6% til 13% for HDL hos pasienter behandlet med Actos. Et lignende resultatmønster ble sett i 24-ukers kombinasjonsbehandlingsstudier av Actos med sulfonylurea eller metformin.
I en kombinasjonsbehandlingsstudie med insulin (16 uker) ble den placebokorrigerte gjennomsnittlige prosentvise endringen fra baseline i triglyseridverdiene for pasienter behandlet med Actos også redusert. En placebokorrigert gjennomsnittlig endring fra baseline i LDL-kolesterol på 7% ble observert for dosegruppen 15 mg. Lignende resultater som de som er nevnt ovenfor for HDL og totalt kolesterol ble observert. Et lignende resultatmønster ble sett i en 24-ukers kombinasjonsterapistudie med Actos med insulin.
Kliniske studier
monoterapi
I USA ble det gjennomført tre randomiserte, dobbeltblinde, placebokontrollerte studier med varighet fra 16 til 26 uker for å evaluere bruken av Actos som monoterapi hos pasienter med diabetes type 2. Disse studiene undersøkte Actos i doser opptil 45 mg eller placebo en gang daglig hos 865 pasienter.
I en 26 ukers dose-varierende studie ble 408 pasienter med diabetes type 2 randomisert til å få 7,5 mg, 15 mg, 30 mg eller 45 mg Actos eller placebo en gang daglig. Terapi med et hvilket som helst tidligere antidiabetisk middel ble avbrutt 8 uker før den dobbeltblinde perioden. Behandling med 15 mg, 30 mg og 45 mg Actos ga statistisk signifikante forbedringer i HbA1c og fastende plasmaglukose (FPG) ved endepunkt sammenlignet med placebo (figur 1, tabell 2).
Figur 1 viser tidsforløpet for endringer i FPG og HbA1c for hele studiepopulasjonen i denne 26-ukers studien.
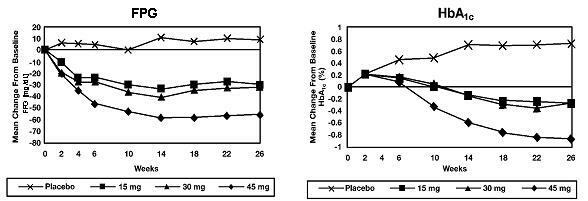
Tabell 2 viser HbA1c og FPG-verdier for hele studiepopulasjonen.
Tabell 2 Glykemiske parametere i en 26-ukers placebokontrollert doserangerende studie
| placebo | Actos 15 mg En gang Daglig |
Actos 30 mg En gang Daglig |
Actos 45 mg En gang Daglig |
|
| TOTAL POPULASJON | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Baseline (gjennomsnitt) | 10.4 | 10.2 | 10.2 | 10.3 |
| Endring fra grunnlinjen (justert gjennomsnitt+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Forskjell fra placebo (justert middel+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Baseline (gjennomsnitt) | 268 | 267 | 269 | 276 |
| Endring fra grunnlinjen (justert gjennomsnitt+) | 9 | -30 | -32 | -56 |
| Forskjell fra placebo (justert middel+) | -39* | -41* | -65* | |
|
+ Justert for baseline, pooled center og pooled center etter behandlingssamhandling * p â ‰ ¤ 0,050 vs. placebo |
Studiepopulasjonen inkluderte pasienter som ikke tidligere var blitt behandlet med antidiabetika (nave; 31%) og pasienter som fikk antidiabetisk medisinering på studietidspunktet (tidligere behandlet; 69%). Dataene for de nave og tidligere behandlede pasientundersettene er vist i tabell 3. Alle pasienter gikk inn i en 8 ukers utvaskings- / innkjøringsperiode før dobbelblind behandling. Denne innkjøringsperioden var assosiert med liten endring i HbA1c og FPG-verdier fra screening til baseline for de ikke-pasientene; imidlertid for den tidligere behandlede gruppen resulterte utvasking fra tidligere antidiabetika medisiner i forverring av glykemisk kontroll og økning i HbA1c og FPG. Selv om de fleste pasienter i den tidligere behandlede gruppen hadde en nedgang fra baseline i HbA1c og FPG med Actos, i mange tilfeller gikk ikke verdiene tilbake til screeningsnivåer ved slutten av studien. Studiedesignet tillot ikke evaluering av pasienter som byttet direkte til Actos fra et annet antidiabetisk middel.
Tabell 3 Glykemiske parametere i en 26-ukers placebokontrollert doserangerende studie
| placebo | Actos 15 mg En gang Daglig |
Actos 30 mg En gang Daglig |
Actos 45 mg En gang Daglig |
|
| Nave til terapi HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Screening (gjennomsnitt) | 9.3 | 10.0 | 9.5 | 9.8 |
| Baseline (gjennomsnitt) | 9.0 | 9.9 | 9.3 | 10.0 |
| Endring fra baseline (justert gjennomsnitt *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Forskjell fra placebo (justert gjennomsnitt *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dL) | N = 25 | N = 26 | N = 26 | N = 21 |
| Screening (gjennomsnitt) | 223 | 245 | 239 | 239 |
| Baseline (gjennomsnitt) | 229 | 251 | 225 | 235 |
| Endring fra baseline (justert gjennomsnitt *) | 16 | -37 | -41 | -64 |
| Forskjell fra placebo (justert gjennomsnitt *) | -52 | -56 | -80 | |
| Tidligere behandlet HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Screening (gjennomsnitt) | 9.3 | 9.0 | 9.1 | 9.0 |
| Baseline (gjennomsnitt) | 10.9 | 10.4 | 10.4 | 10.6 |
| Endring fra baseline (justert gjennomsnitt *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Forskjell fra placebo (justert gjennomsnitt *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dL) | N = 54 | N = 53 | N = 58 | N = 56 |
| Screening (gjennomsnitt) | 222 | 209 | 230 | 215 |
| Baseline (gjennomsnitt) | 285 | 275 | 286 | 292 |
| Endring fra baseline (justert gjennomsnitt *) | 4 | -32 | -27 | -55 |
| Forskjell fra placebo (justert gjennomsnitt *) | -36 | -31 | -59 | |
| * Justert for baseline og basseng sentrum |
I en 24-ukers, placebokontrollert studie ble 260 pasienter med type 2-diabetes randomisert til en av to Actos-behandlingsgrupper med tvangstitrering eller en placebo-gruppe med tosk titrering. Terapi med et hvilket som helst tidligere antidiabetisk middel ble avbrutt 6 uker før den dobbeltblinde perioden. I en Actos-behandlingsgruppe fikk pasientene en initial dose på 7,5 mg en gang daglig. Etter fire uker ble dosen økt til 15 mg en gang daglig, og etter ytterligere fire uker ble dosen økt til 30 mg en gang daglig for resten av studien (16 uker). I den andre behandlingsgruppen Actos fikk pasienter en startdose på 15 mg en gang daglig og ble titrert til 30 mg en gang daglig og 45 mg en gang daglig på lignende måte. Behandling med Actos, som beskrevet, ga statistisk signifikante forbedringer i HbA1c og FPG ved endepunkt sammenlignet med placebo (tabell 4).
Tabell 4 Glykemiske parametere i en 24-ukers placebokontrollert tvangstitreringsstudie
| placebo | Actos 30 mg+ En gang om dagen |
Actos 45 mg+ En gang om dagen |
|
| Total populasjon HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Baseline (gjennomsnitt) | 10.8 | 10.3 | 10.8 |
| Endring fra grunnlinjen (justert gjennomsnitt++) | 0.9 | -0.6 | -0.6 |
| Forskjell fra placebo (justert middel++) | -1.5* | -1.5* | |
| FPG (mg / dL) | N = 78 | N = 82 | N = 85 |
| Baseline (gjennomsnitt) | 279 | 268 | 281 |
| Endring fra grunnlinjen (justert gjennomsnitt++) | 18 | -44 | -50 |
| Forskjell fra placebo (justert middel++) | -62* | -68* | |
|
+ Sluttdose i tvungen titrering ++ Justert for baseline, pooled center og pooled center etter behandlingssamhandling * p â ‰ ¤ 0,050 vs. placebo |
For pasienter som ikke tidligere hadde blitt behandlet med antidiabetika (24%), var middelverdiene ved screening 10,1% for HbA1c og 238 mg / dL for FPG. Ved baseline, mener HbA1c var 10,2% og gjennomsnittlig FPG var 243 mg / dL. Sammenlignet med placebo resulterte behandling med Actos som ble titrert til en sluttdose på 30 mg og 45 mg, redusert fra baseline i gjennomsnittlig HbA1c på 2,3% og 2,6% og gjennomsnittlig FPG på henholdsvis 63 mg / dL og 95 mg / dL. For pasienter som tidligere hadde blitt behandlet med antidiabetika (76%), ble denne medisinen avbrutt ved screening. Gjennomsnittsverdier ved screening var 9,4% for HbA1c og 216 mg / dL for FPG. Ved baseline, mener HbA1c var 10,7% og gjennomsnittlig FPG var 290 mg / dL. Sammenlignet med placebo resulterte behandling med Actos som ble titrert til en sluttdose på 30 mg og 45 mg, redusert fra baseline i gjennomsnittlig HbA1c på 1,3% og 1,4% og gjennomsnittlig FPG på henholdsvis 55 mg / dL og 60 mg / dL. For mange tidligere behandlede pasienter, HbA1c og FPG hadde ikke kommet tilbake til screeningsnivåene ved studiens slutt.
I en 16 ukers studie ble 197 pasienter med diabetes type 2 randomisert til behandling med 30 mg Actos eller placebo en gang daglig. Terapi med et hvilket som helst tidligere antidiabetisk middel ble avbrutt 6 uker før den dobbeltblinde perioden. Behandling med 30 mg Actos ga statistisk signifikante forbedringer i HbA1c og FPG ved endepunkt sammenlignet med placebo (tabell 5).
Tabell 5 Glykemiske parametere i en 16-ukers placebokontrollert studie
| placebo | Actos 30 mg En gang om dagen |
|
| Total populasjon HbA1c (%) |
N = 93 | N = 100 |
| Baseline (gjennomsnitt) | 10.3 | 10.5 |
| Endring fra grunnlinjen (justert gjennomsnitt+) | 0.8 | -0.6 |
| Forskjell fra placebo (justert middel+) | -1.4* | |
| FPG (mg / dL) | N = 91 | N = 99 |
| Baseline (gjennomsnitt) | 270 | 273 |
| Endring fra grunnlinjen (justert gjennomsnitt+) | 8 | -50 |
| Forskjell fra placebo (justert middel+) | -58* | |
|
+ Justert for baseline, pooled center og pooled center etter behandlingssamhandling * p â ‰ ¤ 0,050 vs. placebo |
For pasienter som ikke tidligere hadde blitt behandlet med antidiabetika (40%), var middelverdiene ved screening 10,3% for HbA1c og 240 mg / dL for FPG. Ved baseline, mener HbA1c var 10,4% og gjennomsnittlig FPG var 254 mg / dL. Sammenlignet med placebo resulterte behandling med Actos 30 mg i reduksjon fra basislinjen i gjennomsnittlig HbA1c på 1,0% og gjennomsnittlig FPG på 62 mg / dL. For pasienter som tidligere hadde blitt behandlet med antidiabetika (60%), ble denne medisinen avbrutt ved screening. Gjennomsnittsverdier ved screening var 9,4% for HbA1c og 216 mg / dL for FPG. Ved baseline, mener HbA1c var 10,6% og gjennomsnittlig FPG var 287 mg / dL. Sammenlignet med placebo resulterte behandling med Actos 30 mg i reduksjon fra basislinjen i gjennomsnittlig HbA1c på 1,3% og gjennomsnittlig FPG på 46 mg / dL. For mange tidligere behandlede pasienter, HbA1c og FPG hadde ikke kommet tilbake til screeningsnivåene ved studiens slutt.
Kombinasjonsterapi
Tre 16-ukers, randomiserte, dobbeltblinde, placebokontrollerte kliniske studier og tre 24-ukers, randomiserte, dobbeltblinde, dosekontrollerte kliniske studier ble utført for å evaluere effekten av Actos på glykemisk kontroll hos pasienter med diabetes type 2 som var utilstrekkelig kontrollert (HbA1c â € 8%) til tross for gjeldende behandling med sulfonylurea, metformin eller insulin. Tidligere diabetesbehandling kan ha vært monoterapi eller kombinasjonsbehandling.
Actos Plus Sulfonylurea studier
To kliniske studier ble utført med Actos i kombinasjon med en sulfonylurea. Begge studiene inkluderte pasienter med diabetes type 2 på en sulfonylurea, enten alene eller i kombinasjon med et annet antidiabetisk middel. Alle andre antidiabetika ble trukket tilbake før behandlingsstart. I den første studien ble 560 pasienter randomisert til å få 15 mg eller 30 mg Actos eller placebo en gang daglig i 16 uker i tillegg til deres nåværende sulfonylurea-regime. Sammenlignet med placebo i uke 16 reduserte tilsetningen av Actos til sulfonylurea den gjennomsnittlige HbA1c med 0,9% og 1,3% og gjennomsnittlig FPG med 39 mg / dL og 58 mg / dL for henholdsvis 15 mg og 30 mg doser.
I den andre studien ble 702 pasienter randomisert til å få 30 mg eller 45 mg Actos en gang daglig i 24 uker i tillegg til deres nåværende sulfonylurea-regime. Gjennomsnittlig reduksjon fra baseline ved uke 24 i HbA1c var 1,55% og 1,67% for henholdsvis 30 mg og 45 mg doser. Gjennomsnittlig reduksjon fra baseline i FPG var 51,5 mg / dL og 56,1 mg / dL.
Den terapeutiske effekten av Actos i kombinasjon med sulfonylurea ble observert hos pasienter uavhengig av om pasientene fikk lave, middels eller høye doser sulfonylurea.
Actos Plus Metformin-studier
To kliniske studier ble utført med Actos i kombinasjon med metformin. Begge studiene inkluderte pasienter med diabetes type 2 på metformin, enten alene eller i kombinasjon med et annet antidiabetisk middel. Alle andre antidiabetika ble trukket tilbake før behandlingsstart. I den første studien ble 328 pasienter randomisert til å motta enten 30 mg Actos eller placebo en gang daglig i 16 uker i tillegg til deres nåværende metforminregime. Sammenlignet med placebo i uke 16, reduserte tilsetningen av Actos til metformin den gjennomsnittlige HbA betydelig1c med 0,8% og reduserte gjennomsnittlig FPG med 38 mg / dL.
I den andre studien ble 827 pasienter randomisert til å motta enten 30 mg eller 45 mg Actos en gang daglig i 24 uker i tillegg til deres nåværende metforminregime. Gjennomsnittlig reduksjon fra baseline ved uke 24 i HbA1c var 0,80% og 1,01% for henholdsvis 30 mg og 45 mg doser. Gjennomsnittlig reduksjon fra baseline i FPG var 38,2 mg / dL og 50,7 mg / dL.
Den terapeutiske effekten av Actos i kombinasjon med metformin ble observert hos pasienter uavhengig av om pasientene fikk lavere eller høyere doser metformin.
Actos Plus insulinstudier
To kliniske studier ble utført med Actos i kombinasjon med insulin. Begge studiene inkluderte pasienter med diabetes type 2 på insulin, enten alene eller i kombinasjon med et annet antidiabetisk middel. Alle andre antidiabetika ble trukket tilbake før behandlingsstart. I den første studien ble 566 pasienter som fikk en median på 60,5 enheter per dag med insulin randomisert til motta enten 15 mg eller 30 mg Actos eller placebo en gang daglig i 16 uker i tillegg til insulinet regime. Sammenlignet med placebo i uke 16, reduserte tilsetningen av Actos til insulin betydelig HbA1c med 0,7% og 1,0% og FPG med 35 mg / dL og 49 mg / dL for henholdsvis 15 mg og 30 mg dose.
I den andre studien fikk 690 pasienter som fikk en median på 60,0 enheter per dag med insulin enten 30 mg eller 45 mg Actos en gang daglig i 24 uker i tillegg til deres nåværende insulinregime. Gjennomsnittlig reduksjon fra baseline ved uke 24 i HbA1c var 1,17% og 1,46% for henholdsvis 30 mg og 45 mg doser. Gjennomsnittlig reduksjon fra baseline i FPG var 31,9 mg / dL og 45,8 mg / dL. Forbedret glykemisk kontroll ble ledsaget av gjennomsnittlig reduksjon fra baseline i insulindosebehov på 6,0% og 9,4% per dag for henholdsvis 30 mg og 45 mg dose.
Den terapeutiske effekten av Actos i kombinasjon med insulin ble observert hos pasienter uavhengig av om pasientene fikk lavere eller høyere doser insulin.
topp
Indikasjoner og bruk
Actos er indikert som et supplement til kosthold og trening for å forbedre glykemisk kontroll hos voksne med type 2 diabetes mellitus.
topp
Kontra
Initiering av Actos hos pasienter med etablert New York Heart Association (NYHA) hjertesvikt klasse III eller IV er kontraindisert (se BOKSET ADVARSEL).
Actos er kontraindisert hos pasienter med kjent overfølsomhet for dette produktet eller noen av komponentene.
topp
advarsler
Hjertesvikt og andre hjertevirkninger
Actos, som andre tiazolidindioner, kan forårsake væskeansamling når de brukes alene eller i kombinasjon med andre antidiabetika, inkludert insulin. Væskeretensjon kan føre til eller forverre hjertesvikt. Pasienter bør observeres for tegn og symptomer på hjertesvikt. Hvis disse tegnene og symptomene utvikler seg, bør hjertesvikt håndteres i henhold til gjeldende standarder for omsorg. Videre må seponering eller dosereduksjon av Actos vurderes (se BOKSET ADVARSEL). Pasienter med hjertestatus av NYHA klasse III og IV ble ikke studert under kliniske studier før forhåndsgodkjenning, og Actos anbefales ikke til disse pasientene (se BOKSET ADVARSEL og KONTRA).
I en 16-ukers, amerikansk dobbeltblind, placebokontrollert klinisk studie som involverte 566 pasienter med type 2 diabetes, Actos i doser på 15 mg og 30 mg i kombinasjon med insulin ble sammenlignet med insulinbehandling alene. Denne studien inkluderte pasienter med langvarig diabetes og en høy prevalens av medisinske tilstander som følger: arteriell hypertensjon (57,2%), perifer nevropati (22,6%), koronar hjertesykdom (19,6%), retinopati (13,1%), myokardie infarkt (8,8%), vaskulær sykdom (6,4%), angina pectoris (4,4%), hjerneslag og / eller forbigående iskemisk angrep (4,1%), og kongestiv hjertesvikt (2,3%).
I denne studien var to av de 191 pasientene som fikk 15 mg Actos pluss insulin (1,1%) og to av de 188 pasientene som fikk 30 mg Actos pluss insulin (1,1%) utviklet kongestiv hjertesvikt sammenlignet med ingen av de 187 pasientene på insulinbehandling alene. Alle disse fire pasientene hadde tidligere historier om hjerte- og karsykdommer inkludert koronararteriesykdom, tidligere CABG-prosedyrer og hjerteinfarkt. I en 24-ukers, dosekontrollert studie der Actos ble gitt samtidig med insulin, rapporterte 0,3% av pasientene (1/345) på 30 mg og 0,9% (3/345) pasienter på 45 mg CHF som en alvorlig bivirkning. .
Analyse av data fra disse studiene identifiserte ikke spesifikke faktorer som forutsier økt risiko for kongestiv hjertesvikt ved kombinasjonsbehandling med insulin.
Ved type 2 diabetes og kongestiv hjertesvikt (systolisk dysfunksjon)
En 24-ukers sikkerhetsstudie etter markedsføring ble utført for å sammenligne Actos (n = 262) med glyburid (n = 256) hos ukontrollerte diabetespasienter (gjennomsnittlig HbA1c 8,8% ved baseline) med NYHA klasse II og III hjertesvikt og utkastingsfraksjon mindre enn 40% (gjennomsnittlig EF 30% ved baseline). I løpet av studien ble det rapportert om sykehusinnleggelse over natten for kongestiv hjertesvikt hos 9,9% av pasienter på Actos sammenlignet med 4,7% av pasientene på glyburid med en forskjell i behandlingen observert fra 6 uker. Denne bivirkningen assosiert med Actos var mer markert hos pasienter som brukte insulin ved baseline og hos pasienter over 64 år. Ingen forskjell i kardiovaskulær dødelighet mellom behandlingsgruppene ble observert.
Actos bør settes i gang med den laveste godkjente dosen hvis den er foreskrevet til pasienter med diabetes type 2 og systolisk hjertesvikt (NYHA klasse II). Hvis påfølgende opptrapping av dosen er nødvendig, bør dosen økes gradvis bare etter flere måneders behandling med nøye overvåking for vektøkning, ødem, eller tegn og symptomer på CHF forverring.
Potensiell Pioglitazon klinisk utprøving i makrovaskulære hendelser (PROactive)
I PROactive ble 5238 pasienter med diabetes type 2 og en tidligere historie med makrovaskulær sykdom behandlet med Actos (n = 2605), krafttitrert opp til 45 mg en gang daglig, eller placebo (n = 2633) (se BIVIRKNINGER). Andelen pasienter som hadde en alvorlig hjertesvikt, var høyere for pasienter behandlet med Actos (5,7%, n = 149) enn for pasienter behandlet med placebo (4,1%, n = 108). Dødsfallet etter en rapport om alvorlig hjertesvikt var 1,5% (n = 40) hos pasienter behandlet med Actos og 1,4% (n = 37) hos placebo-behandlede pasienter. Hos pasienter som ble behandlet med et insulinholdig regime ved utgangspunktet, var forekomsten av alvorlig hjertesvikt 6,3% (n = 54/864) med Actos og 5,2% (n = 47/896) med placebo. For de pasientene som ble behandlet med et sulfonylurea-inneholdende regime ved utgangspunktet, var forekomsten av alvorlig hjertesvikt 5,8% (n = 94/1624) med Actos og 4,4% (n = 71/1626) med placebo.
topp
forholdsregler
Generell
Actos utøver sin antihyperglykemiske effekt bare i nærvær av insulin. Derfor bør Actos ikke brukes til pasienter med diabetes type 1 eller til behandling av diabetisk ketoacidose.
Hypoglykemi: Pasienter som får Actos i kombinasjon med insulin eller orale hypoglykemiske midler kan være i faresonen for hypoglykemi, og en reduksjon i dosen av det samtidige midlet kan være nødvendig.
Kardiovaskulær: I U.S. placebokontrollerte kliniske studier som utelukket pasienter med New York Heart Association (NYHA) hjertestatus i klasse III og IV, var forekomsten av alvorlige hjertebivirkninger relatert til volumekspansjon ble ikke økt hos pasienter som ble behandlet med Actos som monoterapi eller i kombinasjon med sulfonylurea eller metformin vs. placebo-behandlede pasienter. I insulinkombinasjonsstudier har et lite antall pasienter med en tidligere historie hjertesykdom utviklet kongestiv hjertesvikt ved behandling med Actos i kombinasjon med insulin (se ADVARSLER). Pasienter med hjertestatus av NYHA klasse III og IV ble ikke studert i disse kliniske studier av Actos. Actos er ikke indikert hos pasienter med NYHA klasse III eller IV hjertestatus.
Etter markedsføring med Actos er tilfeller av kongestiv hjertesvikt rapportert hos pasienter både med og uten tidligere kjent hjertesykdom.
Ødem: Actos bør brukes med forsiktighet hos pasienter med ødem. I alle amerikanske kliniske studier ble ødem rapportert hyppigere hos pasienter behandlet med Actos enn hos placebo-behandlede pasienter og ser ut til å være doserelatert (se BIVIRKNINGER). Etter markedsføring er det mottatt rapporter om igangsettelse eller forverring av ødem. Siden tiazolidinedioner, inkludert Actos, kan forårsake væskeansamling, noe som kan forverre eller føre til kongestiv hjertesvikt, bør Actos brukes med forsiktighet hos pasienter med risiko for hjertesvikt. Pasienter bør overvåkes for tegn og symptomer på hjertesvikt (se BOKSET ADVARSEL, ADVARSLER, og FORHOLDSREGLER).
Vektøkning: Doserelatert vektøkning ble sett med Actos alene og i kombinasjon med andre hypoglykemiske midler (tabell 6). Mekanismen for vektøkning er uklar, men involverer sannsynligvis en kombinasjon av væskeansamling og fettakkumulering.
Tabell 6 Vektendringer (kg) fra baseline under dobbeltblinde kliniske studier med Actos
| Kontrollgruppe (Placebo) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| median (25th/75th persentil) |
median (25th/75th persentil) |
median (25th/75th persentil) |
median (25th/75th persentil) |
||
| monoterapi | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Kombinasjonsterapi | sulfonylurea | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| metformin | -1.4 (-3.2/0.3) n = 160 |
N / A | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| Insulin | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Merk: Forsøksvarighet på 16 til 26 uker |
Eggløsning: Behandling med Actos, som andre tiazolidinedioner, kan føre til eggløsning hos noen premenopausale anovulatoriske kvinner. Som et resultat kan disse pasientene ha økt risiko for graviditet mens de tar Actos. Derfor bør tilstrekkelig prevensjon anbefales hos kvinner før fødsel. Denne mulige effekten er ikke undersøkt i kliniske studier, så hyppigheten av denne forekomsten er ikke kjent.
Hematologic: Actos kan forårsake reduksjon i hemoglobin og hematokrit. Gjennom alle kliniske studier falt gjennomsnittlige hemoglobinverdier med 2% til 4% hos pasienter behandlet med Actos. Disse endringene skjedde hovedsakelig i løpet av de første 4 til 12 ukene av behandlingen og forble relativt konstant deretter. Disse endringene kan ha sammenheng med økt plasmavolum og har sjelden blitt assosiert med noen betydelige hematologiske kliniske effekter (se BIVIRKNINGER, Laboratorieavvik).
Levereffekter: I kliniske studier med forhåndsgodkjenning ble over 4500 personer behandlet med Actos. I amerikanske kliniske studier fikk over 4700 pasienter med diabetes type 2 Actos. Det var ingen bevis for medikamentindusert hepatotoksisitet eller forhøyelse av ALT-nivåer i de kliniske studiene.
Under forhåndsgodkjenning av placebokontrollerte kliniske studier i USA, totalt 4 av 1526 (0,26%) pasienter behandlet med Actos og 2 av 793 (0,25%) placebo-behandlede pasienter hadde ALT-verdier - 3 ganger den øvre grensen for vanlig. ALT-forhøyelsene hos pasienter behandlet med Actos var reversible og var ikke tydelig relatert til terapi med Actos.
Etter markedsføring med Actos har det blitt mottatt rapporter om hepatitt og forhøyet leverenzym til 3 eller flere ganger den øvre normalgrensen. Svært sjelden har disse rapportene involvert leversvikt med og uten dødelig utfall, selv om det ikke er påvist kausalitet.
I påvente av tilgjengeligheten av resultatene av ytterligere store, langvarige kontrollerte kliniske studier og tillegg sikkerhetsdata etter markedsføring, anbefales det at pasienter behandlet med Actos gjennomgår periodisk leverovervåking enzymer.
Serum-ALT-nivåer (alaninaminotransferase) bør evalueres før behandlingen påbegynnes med Actos hos alle pasienter og deretter periodisk etter klinisk vurdering av helsehjelpen profesjonell. Leverfunksjonstester bør også oppnås for pasienter hvis symptomer som tyder på leverfunksjon oppstår, for eksempel kvalme, oppkast, magesmerter, tretthet, anoreksi eller mørk urin. Avgjørelsen om å fortsette pasienten med terapi med Actos bør styres av klinisk skjønn i påvente av laboratorieevalueringer. Hvis gulsott observeres, bør medikamentell behandling seponeres.
Behandling med Actos bør ikke settes i gang hvis pasienten viser klinisk bevis på aktiv leversykdom eller ALT-nivåene overstiger 2,5 ganger den øvre normalgrensen. Pasienter med mildt forhøyede leverenzymer (ALT-nivåer 1 til 2,5 ganger den øvre normalgrensen) kl baseline eller når som helst under behandling med Actos bør evalueres for å bestemme årsaken til leverenzymet høyde. Initiering eller fortsettelse av terapi med Actos hos pasienter med mildt forhøyede leverenzymer bør fortsette med forsiktighet og inkludere passende klinisk oppfølging som kan omfatte hyppigere leverenzym overvåkning. Hvis serumtransaminasenivået er økt (ALT> 2,5 ganger den øvre grensen for normal), leveren funksjonstester bør evalueres oftere til nivåene går tilbake til normal eller forbehandling verdier. Hvis ALT-nivåene overstiger 3 ganger den øvre normalgrensen, bør testen gjentas så snart som mulig. Hvis ALT-nivåene forblir> 3 ganger den øvre normalgrensen, eller hvis pasienten er gulsott, bør Actos-behandlingen avsluttes.
Makulært ødem: Makulært ødem er rapportert etter markedsføring hos diabetespasienter som tok pioglitazon eller et annet tiazolidindion. Noen pasienter hadde uskarpt syn eller nedsatt synsstyrke, men noen pasienter ser ut til å ha blitt diagnostisert ved rutinemessig oftalmologisk undersøkelse. Noen pasienter hadde perifert ødem på det tidspunktet makulær ødem ble diagnostisert. Noen pasienter hadde bedring i sitt makulære ødem etter seponering av tiazolidindion. Det er ukjent om det er en årsakssammenheng mellom pioglitazon og makulært ødem. Pasienter med diabetes bør ha regelmessige øyeundersøkelser av en øyelege i henhold til Standards of Care av American Diabetes Association. I tillegg bør enhver diabetiker som rapporterer noen form for visuelt symptom, omgående henvises til en øyelege, uavhengig av pasientens underliggende medisiner eller andre fysiske funn (se BIVIRKNINGER).
Frakturer: I en randomisert studie (PROactive) hos pasienter med diabetes type 2 (gjennomsnittlig varighet av diabetes 9,5 år), ble det observert en økt forekomst av beinbrudd hos kvinnelige pasienter som tok pioglitazon. Under en gjennomsnittlig oppfølging på 34,5 måneder var forekomsten av beinbrudd hos kvinner 5,1% (44/870) for pioglitazon mot 2,5% (23/905) for placebo. Denne forskjellen ble observert etter det første behandlingsåret og forble i løpet av studien. Flertallet av brudd observert hos kvinnelige pasienter var ikke-vertebrale brudd inkludert underekstremitet og distalt overekstremitet. Det ble ikke observert noen økning i bruddrater hos menn behandlet med pioglitazon 1,7% (30/1735) versus placebo 2,1% (37/1728). Risikoen for brudd bør vurderes ved pleie av pasienter, spesielt kvinnelige pasienter, som er behandlet med pioglitazon og oppmerksomhet bør rettes mot vurdering og opprettholdelse av beinhelse i henhold til gjeldende standarder av omsorg.
Makrovaskulære utfall: Det har ikke vært noen kliniske studier som viser at det foreligger avgjørende bevis for reduksjon av makrovaskulær risiko med Actos eller noe annet antidiabetisk middel.
Laboratorietester
FPG og HbA1c målinger bør utføres med jevne mellomrom for å overvåke glykemisk kontroll og den terapeutiske responsen til Actos.
Leverenzymovervåking anbefales før behandling med Actos initieres hos alle pasienter og med jevne mellomrom etter klinisk vurdering av helsepersonell (se FORHOLDSREGLER, Generelle, levereffekter og BIVIRKNINGER, Serumtransaminase-nivåer).
Informasjon til pasienter
Det er viktig å instruere pasienter å følge kostholdsinstruksjonene og å få testet blodsukker og glykosylert hemoglobin regelmessig. I perioder med stress som feber, traumer, infeksjoner eller kirurgi, kan medisineringskravene endres, og pasientene bør bli påminnet om å søke legehjelp omgående.
Pasienter som opplever en uvanlig rask økning i vekt eller ødem eller som utvikler pustebesvær eller andre symptomer på hjertesvikt mens du er på Actos, bør øyeblikkelig rapportere disse symptomene til sine lege.
Pasienter skal få beskjed om at blodprøver for leverfunksjon vil bli utført før behandlingsstart og deretter periodisk etter klinisk vurdering av helsepersonell. Pasienter skal få beskjed om å søke øyeblikkelig medisinsk råd for uforklarlig kvalme, oppkast, magesmerter, tretthet, anoreksi eller mørk urin.
Pasienter bør få beskjed om å ta Actos en gang daglig. Actos kan tas med eller uten måltider. Hvis en dose går glipp av en dag, bør dosen ikke dobles dagen etter.
Når du bruker kombinasjonsbehandling med insulin eller orale hypoglykemiske midler, er risikoen for hypoglykemi, dens symptomer og behandling og forhold som disponerer for dens utvikling, bør forklares for pasienter og deres familie medlemmer.
Terapi med Actos, som andre tiazolidinedioner, kan føre til eggløsning hos noen premenopausale anovulatoriske kvinner. Som et resultat kan disse pasientene ha økt risiko for graviditet mens de tar Actos. Derfor bør tilstrekkelig prevensjon anbefales hos kvinner før fødsel. Denne mulige effekten er ikke undersøkt i kliniske studier, så hyppigheten av denne forekomsten er ikke kjent.
Narkotikahandel
In vivo-medikamentell interaksjonstudier har antydet at pioglitazon kan være en svak inducer av CYP 450 isoform 3A4-substrat (se KLINISK FARMAKOLOGI, Metabolisme og Legemiddelinteraksjoner).
En enzymhemmer av CYP2C8 (som gemfibrozil) kan øke AUC betydelig pioglitazon og en enzymindusør av CYP2C8 (for eksempel rifampin) kan redusere AUC for pioglitazon. Hvis en hemmer eller inducer av CYP2C8 startes eller stoppes under behandling med pioglitazon, kan det derfor være behov for endringer i diabetesbehandlingen basert på klinisk respons (se KLINISK FARMAKOLOGI, Legemiddelinteraksjoner).
Karsinogenese, mutagenese, svekkelse av fruktbarhet
En to-års karsinogenisitetsstudie ble utført på hann- og hunnrotter i orale doser opp til 63 mg / kg (omtrent 14 ganger den maksimale anbefalte humane orale dosen på 45 mg basert på mg / m2). Medikamentinduserte svulster ble ikke observert i noe organ bortsett fra urinblæren. Godartede og / eller ondartede overgangscelleneoplasmer ble observert hos hannrotter ved 4 mg / kg / dag og over (omtrent lik maksimal anbefalt oral oral dose basert på mg / m2). En to-årig karsinogenisitetsundersøkelse ble utført på hann- og hunnmus i orale doser opp til 100 mg / kg / dag (omtrent 11 ganger den maksimale anbefalte humane orale dosen basert på mg / m2). Ingen medikamentinduserte svulster ble observert i noe organ.
Under prospektiv evaluering av urincytologi som involverte mer enn 1800 pasienter som fikk Actos i kliniske studier opptil ett år i varighet, ble det ikke identifisert noen nye tilfeller av blæresvulster. I to 3-årige studier der pioglitazon ble sammenlignet med placebo eller glyburid, var det 16/3656 (0,44%) rapporter om blærekreft hos pasienter som tar pioglitazon sammenlignet med 5/3679 (0,14%) hos pasienter som ikke tok pioglitazon. Etter å ha ekskludert pasienter der eksponeringen for medikament var mindre enn ett år på diagnosetidspunktet for blærekreft, var det seks (0,16%) tilfeller på pioglitazon og to (0,05%) på placebo.
Pioglitazone HCl var ikke mutagent i et batteri av genetiske toksikologiske studier, inkludert Ames-bakterieanalysen, et pattedyrcelleanlegg mutasjonsanalyse (CHO / HPRT og AS52 / XPRT), en in vitro cytogenetisk analyse ved bruk av CHL-celler, en ikke-planlagt DNA-syntese-analyse og en in vivo mikronukleus analyse.
Ingen bivirkninger på fertilitet ble observert hos hann- og hunnrotter ved orale doser opp til 40 mg / kg pioglitazon HCl daglig før og gjennom parring og svangerskap (omtrent 9 ganger den maksimale anbefalte humane orale dosen basert på mg / m2).
Dyretoksikologi
Hjerteforstørrelse er observert hos mus (100 mg / kg), rotter (4 mg / kg og over) og hunder (3 mg / kg) behandlet oralt med pioglitazon HCl (omtrent 11, 1 og 2 ganger den maksimale anbefalte humane orale dosen for henholdsvis mus, rotter og hunder, basert på mg / m2). I en ettårig rottestudie skjedde medikamentrelatert tidlig død på grunn av tilsynelatende hjerteproblemer ved en oral dose på 160 mg / kg / dag (omtrent 35 ganger maksimal anbefalt oral oral dose basert på mg / m2). Hjerteforstørrelse ble sett i en 13-ukers studie på aper i orale doser på 8,9 mg / kg og over (omtrent 4 ganger den maksimale anbefalte humane orale dosen basert på mg / m2), men ikke i en 52-ukers studie med orale doser opp til 32 mg / kg (omtrent 13 ganger den maksimale anbefalte humane orale dosen basert på mg / m2).
Svangerskap
Graviditet kategori C. Pioglitazon var ikke teratogent hos rotter ved orale doser opp til 80 mg / kg eller hos kaniner gitt opp til 160 mg / kg under organogenese (ca. 17 og 40 ganger den maksimale anbefalte humane orale dosen basert på mg / m2, henholdsvis). Forsinket fødsel og embryotoksisitet (som fremgår av økt postimplantasjonstap, forsinket utvikling og reduserte fostervekter) ble observert hos rotter ved orale doser på 40 mg / kg / dag og over (omtrent 10 ganger den maksimale anbefalte humane orale dosen basert på mg / m2). Ingen funksjonell eller adferds toksisitet ble observert hos avkom fra rotter. Hos kaniner ble embryotoksisitet observert i en oral dose på 160 mg / kg (omtrent 40 ganger den maksimale anbefalte oral oral dose basert på mg / m2). Forsinket postnatal utvikling, tilskrevet redusert kroppsvekt, ble observert hos avkom fra rotter i orale doser på 10 mg / kg og over i løpet av sen svangerskapsperiode og amming (omtrent 2 ganger den maksimale anbefalte humane orale dosen basert på mg / m2).
Det er ingen tilstrekkelige og godt kontrollerte studier på gravide. Actos skal bare brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Fordi aktuell informasjon antyder sterkt at unormale blodsukkernivåer under graviditet er assosiert med en høyere forekomst av medfødte avvik, i tillegg som økt neonatal sykelighet og dødelighet, anbefaler de fleste eksperter at insulin brukes under graviditet for å opprettholde blodsukkernivået så nær det normale som mulig.
Sykepleiermødre
Pioglitazon skilles ut i melken til lakterende rotter. Det er ikke kjent om Actos skilles ut i morsmelk. Fordi mange medisiner skilles ut i morsmelk, bør Actos ikke gis til en ammende kvinne.
Pediatrisk bruk
Sikkerhet og effektivitet av Actos hos barn er ikke fastslått.
Eldre bruk
Omtrent 500 pasienter i placebokontrollerte kliniske studier av Actos var 65 år og over. Ingen signifikante forskjeller i effektivitet og sikkerhet ble observert mellom disse pasientene og yngre pasienter.
topp
Bivirkninger
Over 8500 pasienter med diabetes type 2 har blitt behandlet med Actos i randomiserte, dobbeltblinde, kontrollerte kliniske studier. Dette inkluderer 2605 høyrisikopasienter med type 2-diabetes behandlet med Actos fra den PROactive kliniske studien. Over 6000 pasienter har blitt behandlet i 6 måneder eller lenger, og over 4500 pasienter i ett år eller lenger. Over 3000 pasienter har fått Actos i minst 2 år.
Den totale forekomsten og typer bivirkninger rapportert i placebokontrollerte kliniske studier av Actos monoterapi i doser på 7,5 mg, 15 mg, 30 mg eller 45 mg en gang daglig er vist i tabell 7.
Tabell 7 Placebokontrollerte kliniske studier av Actos monoterapi: Bivirkninger rapportert med en frekvens - 5% av pasienter behandlet med Actos
| (% av pasientene) | ||
| placebo N = 259 |
Actos N = 606 |
|
| Øvre luftveisinfeksjon | 8.5 | 13.2 |
| Hodepine | 6.9 | 9.1 |
| bihulebetennelse | 4.6 | 6.3 |
| myalgi | 2.7 | 5.4 |
| Tannlidelse | 2.3 | 5.3 |
| Diabetes Mellitus forverret | 8.1 | 5.1 |
| faryngitt | 0.8 | 5.1 |
For de fleste kliniske bivirkninger var forekomsten lik for grupper behandlet med Actos monoterapi og de som ble behandlet i kombinasjon med sulfonylurea, metformin og insulin. Det var en økning i forekomsten av ødem hos pasientene som ble behandlet med Actos og insulin sammenlignet med insulin alene.
I en 16-ukers, placebokontrollert Actos pluss insulin-studie (n = 379), ble 10 pasienter behandlet med Actos pluss insulin utviklet dyspné og utviklet også på et tidspunkt under behandlingen enten vektendring eller ødem. Syv av disse 10 pasientene fikk diuretika for å behandle disse symptomene. Dette ble ikke rapportert i insulin pluss placebogruppen.
Forekomsten av uttak fra placebokontrollerte kliniske studier på grunn av en annen bivirkning enn hyperglykemi var lik for pasienter behandlet med placebo (2,8%) eller Actos (3,3%).
I kontrollerte kombinasjonsbehandlingsstudier med enten sulfonylurea eller insulin, ble mild til moderat hypoglykemi, som ser ut til å være doserelatert, rapportert (se FORHOLDSREGLER, Generelt, Hypoglykemi og Dosering og administrasjon, Kombinasjonsbehandling).
I amerikanske dobbeltblinde studier ble det rapportert anemi hos 2% av pasientene som ble behandlet med Actos pluss sulfonylurea, metformin eller insulin (se FORHOLDSREGLER, General, hematologisk).
I monoterapistudier ble det rapportert ødem for 4,8% (med doser fra 7,5 mg til 45 mg) av pasienter behandlet med Actos mot 1,2% av placebo-behandlede pasienter. I kombinasjonsterapistudier ble det rapportert ødem for 7,2% av pasientene som ble behandlet med Actos og sulfonylurea sammenlignet med 2,1% av pasientene som bare hadde sulfonylurea. I kombinasjonsterapistudier med metformin ble ødemer rapportert hos 6,0% av pasientene som hadde kombinasjonsbehandling sammenlignet med 2,5% av pasientene på metformin alene. I kombinasjonsbehandlingsstudier med insulin ble ødemer rapportert hos 15,3% av pasientene på kombinasjonsbehandling sammenlignet med 7,0% av pasientene på insulin alene. De fleste av disse hendelsene ble ansett som milde eller moderate i intensitet (se FORHOLDSREGLER, General, ødemer).
I en 16-ukers klinisk studie med insulin pluss Actos kombinasjonsbehandling utviklet flere pasienter kongestiv hjertesvikt på kombinasjonsbehandling (1,1%) sammenlignet med ingen på insulin alene (se ADVARSLER, Hjertesvikt og andre hjerteeffekter).
Potensiell Pioglitazon klinisk utprøving i makrovaskulære hendelser (PROactive)
I PROactive var 5238 pasienter med diabetes type 2 og en tidligere historie med makrovaskulær sykdom behandlet med Actos (n = 2605), krafttitrert opp til 45 mg daglig eller placebo (n = 2633) i tillegg til standard av omsorg. Nesten alle forsøkspersoner (95%) fikk kardiovaskulære medisiner (betablokkere, ACE-hemmere, ARB, kalsiumkanalblokkere, nitrater, diuretika, aspirin, statiner, fibrater). Pasientene hadde en gjennomsnittsalder på 61,8 år, gjennomsnittlig varighet av diabetes 9,5 år og gjennomsnittlig HbA1c 8,1%. Gjennomsnittlig varighet av oppfølgingen var 34,5 måneder. Hovedmålet med denne studien var å undersøke effekten av Actos på dødeligheten og makrovaskulær sykelighet hos pasienter med type 2 diabetes mellitus som hadde høy risiko for makrovaskulære hendelser. Den primære effektvariabelen var tiden til den første forekomsten av en hvilken som helst hendelse i det kardiovaskulære sammensatte endepunktet (se tabell 8 nedenfor). Selv om det ikke var statistisk signifikant forskjell mellom Actos og placebo for den 3-årige forekomsten av en første hendelse i denne sammensatte, var det ingen økning i dødelighet eller i totale makrovaskulære hendelser med Actos.
Tabell 8 Antall første og totale hendelser for hver komponent innenfor det kardiovaskulære sammensatte sluttpunktet
| placebo N = 2633 |
Actos N = 2605 |
|||
| Kardiovaskulære hendelser | Første hendelser (N) |
Totalt antall hendelser (N) |
Første hendelser (N) |
Totalt antall hendelser (N) |
| Enhver hendelse | 572 | 900 | 514 | 803 |
| Dødelighet av alle årsaker | 122 | 186 | 110 | 177 |
| Ikke-dødelig MI | 118 | 157 | 105 | 131 |
| Stroke | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Hjerteinngrep | 101 | 240 | 101 | 195 |
| Major amputasjon av bena | 15 | 28 | 9 | 28 |
| Beinrevaskularisering | 57 | 92 | 71 | 115 |
Rapporteringer om markedsføring av nybegynnelse eller forverring av makulært ødem med nedsatt synsskarphet er også mottatt (se se FORHOLDSREGLER, General, Macular Edema).
Laboratorieavvik
Hematologic: Actos kan forårsake reduksjon i hemoglobin og hematokrit. Fallet i hemoglobin og hematokrit med Actos ser ut til å være doserelatert. Gjennom alle kliniske studier falt gjennomsnittlige hemoglobinverdier med 2% til 4% hos pasienter behandlet med Actos. Disse endringene skjedde vanligvis i løpet av de første 4 til 12 ukene av behandlingen og forble relativt stabile deretter. Disse endringene kan ha sammenheng med økt plasmavolum assosiert med Actos-terapi og har sjelden vært assosiert med noen betydelige hematologiske kliniske effekter.
Serumtransaminase-nivåer: I løpet av alle kliniske studier i USA hadde 14 av 4780 (0,30%) pasienter behandlet med Actos ALT-verdier - 3 ganger den øvre normalgrensen under behandlingen. Alle pasienter med oppfølgingsverdier hadde reversible forhøyninger i ALT. I populasjonen av pasienter behandlet med Actos ble middelverdiene for bilirubin, AST, ALT, alkalisk fosfatase og GGT redusert ved siste besøk sammenlignet med baseline. Færre enn 0,9% av pasientene som ble behandlet med Actos ble trukket fra kliniske studier i USA på grunn av unormale leverfunksjonstester.
I kliniske studier med forhåndsgodkjenning var det ingen tilfeller av idiosynkratiske medikamentreaksjoner som førte til leversvikt (se FORHOLDSREGLER, Generelle, levereffekter).
CPK-nivåer: Under nødvendig laboratorietesting i kliniske studier ble sporadiske, forbigående forhøyninger i kreatin-fosfokinase-nivåer (CPK) observert. En isolert høyde til mer enn 10 ganger den øvre normalgrensen ble observert hos 9 pasienter (verdier 2150 til 11400 IE / L). Seks av disse pasientene mottok Actos, to pasienter hadde fullført studien medisinering på tidspunktet for den forhøyede verdien, og en pasient avbrutt studiemedisinen på grunn av høyde. Disse forhøyningene løste seg uten noen tilsynelatende kliniske følger. Forholdet mellom disse hendelsene og Actos-terapi er ukjent.
topp
Overdose
Under kontrollerte kliniske studier ble ett tilfelle av overdose med Actos rapportert. En mannlig pasient tok 120 mg per dag i fire dager, deretter 180 mg per dag i syv dager. Pasienten benektet kliniske symptomer i løpet av denne perioden.
Ved overdosering bør passende støttende behandling settes i gang i henhold til pasientens kliniske tegn og symptomer.
topp
Dosering og administrasjon
Actos bør tas en gang daglig uten hensyn til måltider.
Behandlingen av antidiabetisk behandling bør individualiseres. Ideelt sett bør responsen på terapi evalueres ved bruk av HbA1c som er en bedre indikator på langsiktig glykemisk kontroll enn FPG alene. HbA1c reflekterer glykemi de siste to til tre månedene. Ved klinisk bruk anbefales det at pasienter behandles med Actos i en periode som er tilstrekkelig til å evaluere endring i HbA1c (tre måneder) med mindre glykemisk kontroll forverres. Etter igangsetting av Actos eller med doseøkning, bør pasienter overvåkes nøye for bivirkninger relatert til væskeansamling (se BOKSET ADVARSEL og ADVARSLER).
monoterapi
Actos monoterapi hos pasienter som ikke er tilstrekkelig kontrollert med kosthold og trening, kan startes med 15 mg eller 30 mg en gang daglig. For pasienter som reagerer utilstrekkelig på den første dosen av Actos, kan dosen økes i trinn på opptil 45 mg en gang daglig. For pasienter som ikke svarer tilstrekkelig på monoterapi, bør kombinasjonsbehandling vurderes.
Kombinasjonsterapi
Sulfonylurea: Actos i kombinasjon med en sulfonylurea kan startes med 15 mg eller 30 mg en gang daglig. Den nåværende sulfonylurea-dosen kan fortsettes etter oppstart av Actos-terapi. Hvis pasienter rapporterer hypoglykemi, bør dosen av sulfonylurea reduseres.
Metformin: Actos i kombinasjon med metformin kan initieres med 15 mg eller 30 mg en gang daglig. Den nåværende metformindosen kan fortsettes etter oppstart av Actos-terapi. Det er usannsynlig at metformindosen vil kreve justering på grunn av hypoglykemi under kombinasjonsbehandling med Actos.
Insulin: Actos i kombinasjon med insulin kan initieres på 15 mg eller 30 mg en gang daglig. Den nåværende insulindosen kan fortsettes etter oppstart av Actos-terapi. Hos pasienter som får Actos og insulin, kan insulindosen reduseres med 10% til 25% hvis pasienten rapporterer hypoglykemi eller hvis glukosekonsentrasjonen i plasma reduseres til under 100 mg / dL. Ytterligere justeringer bør individualiseres basert på glukosesenkende respons.
Maksimal anbefalt dose
Dosen av Actos bør ikke overstige 45 mg en gang daglig i monoterapi eller i kombinasjon med sulfonylurea, metformin eller insulin.
Dosejustering til pasienter med nedsatt nyrefunksjon anbefales ikke (se KLINISK FARMAKOLOGI, Farmakokinetikk og stoffskifte.
Behandling med Actos bør ikke settes i gang hvis pasienten viser klinisk bevis på aktiv leversykdom eller økte serumtransaminasenivåer (ALT større enn 2,5 ganger den øvre normalgrensen) ved behandlingsstart (se FORHOLDSREGLER, Generelle, levereffekter og KLINISK FARMAKOLOGI, Spesielle personer, nedsatt leverfunksjon). Leverenzymovervåking anbefales for alle pasienter før oppstart av terapi med Actos og med jevne mellomrom (se FORHOLDSREGLER, Generelle, levereffekter).
Det foreligger ingen data om bruk av Actos hos pasienter under 18 år; derfor anbefales ikke bruk av Actos til barn.
Ingen data er tilgjengelige om bruk av Actos i kombinasjon med en annen tiazolidindion.
topp
Hvordan leveres
Actos er tilgjengelig i 15 mg, 30 mg og 45 mg tabletter som følger:
15 mg tablett: hvit til off-white, rund, konveks, ikke-scoret tablett med "Actos" på den ene siden, og "15" på den andre, tilgjengelig i:
NDC 64764-151-04 Flasker på 30
NDC 64764-151-05 Flasker på 90
NDC 64764-151-06 Flasker på 500
30 mg tablett: hvit til off-white, rund, flat, ikke-scoret tablett med "Actos" på den ene siden, og "30" på den andre, tilgjengelig i:
NDC 64764-301-14 Flasker på 30
NDC 64764-301-15 Flasker på 90
NDC 64764-301-16 Flasker på 500
45 mg tablett: hvit til off-white, rund, flat, ikke-scoret tablett med "Actos" på den ene siden og "45" på den andre, tilgjengelig på:
NDC 64764-451-24 Flasker på 30
NDC 64764-451-25 Flasker på 90
NDC 64764-451-26 Flasker på 500
OPPBEVARING
Oppbevares ved 25 ° C; utflukter tillatt til 15-30 ° C (59-86 ° F) [se USP kontrollert romtemperatur]. Hold beholderen tett lukket, og beskytt mot fuktighet og fuktighet.
topp
referanser
- Deng, LJ, et al. Effekt av gemfibrozil på farmakokinetikken til pioglitazon. Eur J Clin Pharmacol 2005; 61: 831-836, tabell 1.
2. Jaakkola, T, et al. Effekt av rifampicin på farmakokinetikken til pioglitazon. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Bare Rx
Laget av:
Takeda Pharmaceutical Company Limited
Osaka, Japan
Markedsført av:
Takeda Pharmaceuticals America, Inc.
Én Takeda Parkway
Deerfield, IL 60015
Actos® er et registrert varemerke for Takeda Pharmaceutical Company Limited og brukt under lisens av Takeda Pharmaceuticals America, Inc.
Alle andre varemerkenavn tilhører deres respektive eiere.
Sist oppdatert: 08/09
Actos, pioglitazone hcl, pasientinformasjon (på vanlig engelsk)
Detaljert informasjon om tegn, symptomer, årsaker, behandling av diabetes
Informasjonen i denne monografien er ikke ment å dekke all mulig bruk, instruksjoner, forholdsregler, medikamentinteraksjoner eller uheldige effekter. Denne informasjonen er generalisert og er ikke ment som spesifikk medisinsk råd. Hvis du har spørsmål om medisinene du tar eller ønsker mer informasjon, bør du kontakte lege, apotek eller sykepleier.
tilbake til: Bla gjennom alle medisiner for diabetes


