Avandia for behandling av diabetes
Merkenavn: AVANDIA
Generisk navn: rosiglitazonmaleat
Innhold:
Indikasjoner og bruk
Dosering og administrasjon
Doseringsformer og -sterker
Kontra
Advarsler og forsiktighetsregler
Bivirkninger
Narkotikahandel
Bruk i spesifikke befolkninger
Overdosering dosering~~POS=HEADCOMP
Beskrivelse
Klinisk farmakologi
Ikke-klinisk toksikologi
Kliniske studier
Hvordan leveres
Avandia, rosiglitazonmaleat, pasientinformasjon (på vanlig engelsk)
ADVARSEL
KONGESTIV HJERTESVIKLING OG MYOCARDIAL ISCHEMIA
- Tiazolidinedioner, inkludert rosiglitazon, forårsaker eller forverrer kongestiv hjertesvikt hos noen pasienter [se ADVARSLER OG FORHOLDSREGLER]. Etter igangsetting av AVANDIA, og etter økning av dosen, observer pasienter nøye for tegn og symptomer på hjertesvikt (inkludert overdreven, rask vektøkning, dyspné og / eller ødem). Hvis disse tegnene og symptomene utvikler seg, skal hjertesvikt håndteres i henhold til gjeldende standarder for omsorg. Videre må seponering eller dosereduksjon av AVANDIA vurderes.
- AVANDIA anbefales ikke til pasienter med symptomatisk hjertesvikt. Initiering av AVANDIA hos pasienter med etablert NYHA klasse III eller IV hjertesvikt er kontraindisert. [Se KONTRA og ADVARSLER OG FORHOLDSREGLER.]
- En metaanalyse av 42 kliniske studier (gjennomsnittlig varighet 6 måneder; 14 237 pasienter totalt), hvorav de fleste sammenlignet AVANDIA med placebo, viste at AVANDIA var assosiert med økt risiko for hjerteinfarkt, iskemiske hendelser som angina eller hjerteinfarkt. Tre andre studier (gjennomsnittlig varighet 41 måneder; 14 067 pasienter), sammenlignet AVANDIA med noen andre godkjente orale antidiabetika eller placebo, har ikke bekreftet eller ekskludert denne risikoen. I sin helhet er tilgjengelige data om risikoen for myokardiell iskemi ikke entydige. [Se ADVARSLER OG FORHOLDSREGLER.]
topp
Indikasjoner og bruk
Monoterapi og kombinasjonsterapi
AVANDIA er indikert som et supplement til kosthold og trening for å forbedre glykemisk kontroll hos voksne med type 2 diabetes mellitus.
Viktige begrensninger i bruken
- På grunn av sin virkningsmekanisme er AVANDIA bare aktiv i nærvær av endogent insulin. Derfor bør AVANDIA ikke brukes til pasienter med diabetes mellitus type 1 eller til behandling av diabetisk ketoacidose.
- Samtidig administrering av AVANDIA og insulin anbefales ikke.
- Bruk av AVANDIA med nitrater anbefales ikke.
topp
Dosering og administrasjon
Behandlingen av antidiabetisk behandling bør individualiseres. Alle pasienter bør starte AVANDIA i den laveste anbefalte dosen. Ytterligere økning i dosen av AVANDIA bør ledsages av nøye overvåking for bivirkninger relatert til væskeansamling [se Boxed Warning og ADVARSLER og FORHOLDSREGLER].
AVANDIA kan administreres i en startdose på 4 mg enten som en enkelt daglig dose eller i to delte doser. For pasienter som reagerer utilstrekkelig etter 8 til 12 ukers behandling, bestemt ved reduksjon i fastende plasmaglukose (FPG), kan dosen økes til 8 mg daglig ved monoterapi eller i kombinasjon med metformin, sulfonylurea eller sulfonylurea plus metformin. Reduksjoner i glykemiske parametere etter dose og diett er beskrevet under Kliniske studier. AVANDIA kan tas med eller uten mat.
Den totale daglige dosen av AVANDIA bør ikke overstige 8 mg.
monoterapi
Den vanlige startdosen av AVANDIA er 4 mg administrert enten som en enkelt dose en gang daglig eller i delte doser to ganger daglig. I kliniske studier resulterte 4 mg-behandlingen to ganger daglig i den største reduksjonen i FPG og hemoglobin A1c (HbA1c).
Kombinasjon med Sulfonylurea eller Metformin
Når AVANDIA legges til eksisterende terapi, kan den / de nåværende dosen (e) av midlet / midlene fortsettes ved påbegynt behandling med AVANDIA.
sulfonylurea: Når den brukes i kombinasjon med sulfonylurea, er den vanlige startdosen av AVANDIA 4 mg administrert som enten en enkelt dose en gang daglig eller i delte doser to ganger daglig. Hvis pasienter rapporterer hypoglykemi, bør dosen av sulfonylurea reduseres.
metformin: Den vanlige startdosen av AVANDIA i kombinasjon med metformin er 4 mg administrert som enten en enkelt dose en gang daglig eller i delte doser to ganger daglig. Det er usannsynlig at metformindosen vil kreve justering på grunn av hypoglykemi under kombinasjonsbehandling med AVANDIA.
Kombinasjon med Sulfonylurea Plus Metformin
Den vanlige startdosen av AVANDIA i kombinasjon med en sulfonylurea pluss metformin er 4 mg administrert som en enkelt dose en gang daglig eller delte doser to ganger daglig. Hvis pasienter rapporterer hypoglykemi, bør dosen av sulfonylurea reduseres.
Spesifikke pasientpopulasjoner
Nedsatt nyrefunksjon: Ingen dosejustering er nødvendig når AVANDIA brukes som monoterapi hos pasienter med nedsatt nyrefunksjon. Siden metformin er kontraindisert hos slike pasienter, er samtidig administrering av metformin og AVANDIA også kontraindisert hos pasienter med nedsatt nyrefunksjon.
Nedsatt leverfunksjon: Leverenzymer skal måles før behandling med AVANDIA igangsettes. Behandling med AVANDIA skal ikke igangsettes hvis pasienten viser klinisk bevis på at det er aktivt leversykdom eller økte serumtransaminasinnivåer (ALT> 2,5X øvre normalgrense ved starten av terapi). Etter igangsetting av AVANDIA, bør leverenzymer overvåkes regelmessig i henhold til den kliniske vurderingen fra helsepersonellet. [Se ADVARSLER og FORHOLDSREGLER og KLINISK FARMAKOLOGI.]
Pediatrisk: Data er utilstrekkelige for å anbefale pediatrisk bruk av AVANDIA [se BRUK I SPESIFIKKE POPULASJONER].
topp
Doseringsformer og styrker
Pentagonal filmdrasjert TILTAB tablett inneholder rosiglitazon som maleat som følger:
- 2 mg - rosa, preget med SB på den ene siden og 2 på den andre
- 4 mg - oransje, preget med SB på den ene siden og 4 på den andre
- 8 mg - rødbrun, preget med SB på den ene siden og 8 på den andre
topp
Kontra
Initiering av AVANDIA hos pasienter med etablert New York Heart Association (NYHA) hjertesvikt klasse III eller IV er kontraindisert [se BOKSET ADVARSEL].
topp
Advarsler og forsiktighetsregler
Hjertesvikt
AVANDIA kan, som andre tiazolidindioner, alene eller i kombinasjon med andre antidiabetika, forårsake væskeansamling, noe som kan forverre eller føre til hjertesvikt. Pasienter bør observeres for tegn og symptomer på hjertesvikt. Hvis disse tegnene og symptomene utvikler seg, skal hjertesvikt håndteres i henhold til gjeldende standarder for omsorg. Videre må seponering eller dosereduksjon av rosiglitazon vurderes [se BOKSET ADVARSEL].
Pasienter med kongestiv hjertesvikt (CHF) NYHA klasse I og II behandlet med AVANDIA har økt risiko for hjerte- og karsykdommer. En 52-ukers, dobbeltblind, placebokontrollert ekkokardiografisk studie ble utført hos 224 pasienter med type 2 diabetes mellitus og NYHA klasse I eller II CHF (utstøtningsfraksjon - 45%) på antidiabetisk bakgrunn og CHF terapi. En uavhengig komité gjennomførte en blindet evaluering av væskerelaterte hendelser (inkludert kongestiv hjertesvikt) og sykehusinnleggelser i henhold til forhåndsdefinerte kriterier (Bedømmelse). Bortsett fra vurderingen ble andre kardiovaskulære bivirkninger rapportert av etterforskerne. Selv om det ikke ble observert noen forskjell i behandlingen i endring fra utgangspunktet for utkastingsfraksjoner, mer kardiovaskulære bivirkninger ble observert etter behandling med AVANDIA sammenlignet med placebo i løpet av 52-ukers studie. (Se tabell 1.)
Tabell 1. Emergent Cardiovascular Bivirkninger hos pasienter med kongestiv hjertesvikt (NYHA klasse I og II) behandlet med AVANDIA eller placebo (i tillegg til bakgrunn antidiabetisk og CHF-terapi)
| arrangementer | Avandia N = 110 n (%) |
placebo N = 114 n (%) |
| pådømt | ||
| Kardiovaskulære dødsfall | 5 (5%) | 4 (4%) |
| CHF forverres | 7 (6%) | 4 (4%) |
| - med sykehusinnleggelse over natten | 5 (5%) | 4 (4%) |
| - uten sykehusinnleggelse over natten | 2 (2%) | 0 (0%) |
| Nytt eller forverret ødem | 28 (25%) | 10 (9%) |
| Ny eller forverret dyspné | 29 (26%) | 19 (17%) |
| Økninger i CHF medisiner | 36 (33%) | 20 (18%) |
| Kardiovaskulær sykehusinnleggelse * | 21 (19%) | 15 (13%) |
| Etterforsker-rapportert, ikke-dømt | ||
| Iskemiske bivirkninger | 10 (9%) | 5 (4%) |
| - Hjerteinfarkt | 5 (5%) | 2 (2%) |
| - Angina | 6 (5%) | 3 (3%) |
| * Inkluderer sykehusinnleggelse av kardiovaskulær grunn. |
Initiering av AVANDIA hos pasienter med etablert NYHA klasse III eller IV hjertesvikt er kontraindisert. AVANDIA anbefales ikke til pasienter med symptomatisk hjertesvikt. [Se BOKSET ADVARSEL.]
Pasienter som har akutte koronarsyndromer er ikke studert i kontrollerte kliniske studier. Med tanke på potensialet for utvikling av hjertesvikt hos pasienter som har en akutt koronar hendelse, er ikke initiering av AVANDIA anbefalt for pasienter som opplever en akutt koronar hendelse, og seponering av AVANDIA i denne akutte fasen bør være regnet som.
Pasienter med hjertestatus av NYHA klasse III og IV (med eller uten CHF) er ikke studert i kontrollerte kliniske studier. AVANDIA anbefales ikke til pasienter med NYHA klasse III og IV hjertestatus.
Myokardiell iskemi
Metaanalyse av myokardiell iskemi i en gruppe av 42 kliniske studier
En metaanalyse ble utført retrospektivt for å vurdere kardiovaskulære bivirkninger rapportert over 42 dobbeltblinde, randomiserte, kontrollerte kliniske studier (gjennomsnittlig varighet 6 måneder).1
Disse studiene hadde blitt utført for å vurdere glukosesenkende effekt i diabetes type 2, og prospektiv planlagt vurdering av kardiovaskulære hendelser hadde ikke skjedd i forsøkene. Noen studier var placebokontrollerte og noen brukte aktive orale antidiabetika som kontroller. Placebokontrollerte studier inkluderte monoterapiforsøk (monoterapi med AVANDIA versus placebo monoterapi) og tilleggsforsøk (AVANDIA eller placebo, tilsatt sulfonylurea, metformin eller insulin). Aktive kontrollstudier inkluderte monoterapiforsøk (monoterapi med AVANDIA versus sulfonylurea eller metformin monoterapi) og tilleggsforsøk (AVANDIA pluss sulfonylurea eller AVANDIA pluss metformin, versus sulfonylurea pluss metformin). Totalt 14.237 pasienter ble inkludert (8 604 i behandlingsgrupper som inneholder AVANDIA, 5 533 i komparatorgrupper), med 4.143 pasientårs eksponering for AVANDIA og 2.675 pasientår med eksponering for komparator. Myokardielle iskemiske hendelser inkluderer angina pectoris, angina pectoris forverret, ustabil angina, hjertestans, smerter i brystet, koronar arterie-okklusjon, dyspné, hjerteinfarkt, koronar trombose, hjerte-iskemi, koronar-sykdom og koronar-arterie lidelse. I denne analysen, økt risiko for hjerte-iskemi med AVANDIA kontra sammenliknede sammenligninger ble observert (2% AVANDIA mot 1,5% komparatorer, oddsforhold 1,4, 95% konfidensintervall [CI] 1,1, 1.8). En økt risiko for iskemiske myokardielle hendelser med AVANDIA ble observert i placebokontrollerte studier, men ikke i de aktivt kontrollerte studiene. (Se figur 1.)
En større økt risiko for iskemiske myokardielle hendelser ble observert i studier der AVANDIA ble tilsatt til insulin (2,8% for AVANDIA pluss insulin mot 1,4% for placebo pluss insulin, [ELLER 2,1, 95% KI 0,9, 5.1]). Denne økte risikoen gjenspeiler en forskjell på 3 hendelser per 100 pasientår (95% KI -0,1, 6,3) mellom behandlingsgrupper. [Se ADVARSLER OG FORHOLDSREGLER.]
Figur 1. Forest Plot of Odds Ratios (95% Confidence Intervals) for myocardial ischemic events in the Meta-analysis of 42 Clinical Trials
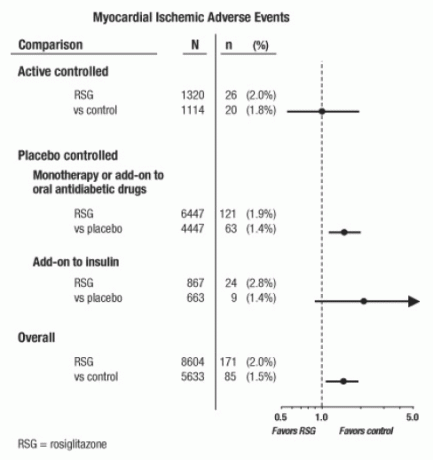
En større økt risiko for hjerteinfarkt ble også observert hos pasienter som fikk AVANDIA og bakgrunnsnitratbehandling. For AVANDIA (N = 361) kontra kontroll (N = 244) hos nitratbrukere var oddsforholdet 2,9 (95% CI 1,4, 5,9), mens for ikke-nitratbrukere (omtrent 14 000 pasienter totalt), var oddsforholdet 1,3 (95% KI 0,9, 1.7). Denne økte risikoen representerer en forskjell på 12 hjerte-iskemiske hendelser per 100 pasientår (95% KI 3,3, 21,4). De fleste av nitratbrukere hadde etablert koronar hjertesykdom. Blant pasienter med kjent koronar hjertesykdom som ikke var på nitratbehandling, ble det ikke påvist økt risiko for hjerte-iskemiske hendelser for AVANDIA versus komparator.
Myokardiske iskemiske hendelser i store langsiktige, prospektive, randomiserte kontrollerte studier av AVANDIA
Data fra 3 andre store, langsiktige, prospektive, randomiserte, kontrollerte kliniske studier av AVANDIA ble vurdert separat fra metaanalysen. Disse tre studiene inkluderer totalt 14 067 pasienter (behandlingsgrupper som inneholder AVANDIA N = 6,311, komparator gruppe N = 7 756), med pasientårs eksponering på 21 803 pasientår for AVANDIA og 25 998 pasientår for komparator. Oppfølgingens varighet overskred 3 år i hver studie. ADOPT (A Diabetes Outuits Progression Trial) var en 4- til 6-årig randomisert, aktiv-kontrollert studie på nylig diagnostiserte pasienter med diabetes type 2 som ikke hadde fått medisinbehandling.
Det var en effektivitets- og generell sikkerhetsstudie som ble designet for å undersøke holdbarheten til
AVANDIA som monoterapi (N = 1 456) for glykemisk kontroll i diabetes type 2, med komparatorarmer av sulfonylurea monoterapi (N = 1 441) og metformin monoterapi (N = 1 454). DREAM (Diabetes Reduction Assessment with Rosiglitazone and Ramipril Medication, publisert rapport2) var en 3- til 5-årig randomisert, placebokontrollert studie hos pasienter med nedsatt glukosetoleranse og / eller nedsatt faste glukose. Den hadde en 2x2 fabrikkutforming, beregnet på å evaluere effekten av AVANDIA, og separat av ramipril (en angiotensinkonverterende enzymhemmende [ACEI]), på progresjon til åpenbar diabetes. I DREAM var 2.635 pasienter i behandlingsgrupper som inneholder AVANDIA, og 2.634 var i behandlingsgrupper som ikke inneholdt AVANDIA.Interimsresultater er publisert 3 for RECORD (Rosiglitazone Evalued for Cardiac Outuits and Regulation of Glycemia in Diabetes), en pågående open-label, 6-års kardiovaskulære utfallsstudie hos pasienter med diabetes type 2 med en gjennomsnittlig behandling varighet på 3,75 år. RECORD inkluderer pasienter som har sviktet metformin eller sulfonylurea monoterapi; de som har mislykket metformin, blir randomisert til å motta enten tillegg AVANDIA eller add-on sulfonylurea, og de som har mislyktes sulfonylurea, blir randomisert til å motta enten tillegg AVANDIA eller tillegg metformin. I RECORD mottar totalt 2.220 pasienter tillegg AVANDIA, og 2.227 pasienter er på et av tilleggsregimene som ikke inneholder AVANDIA.
For disse tre forsøkene ble analyser utført ved bruk av en sammensetning av viktige bivirkninger i hjerte-kar (hjerteinfarkt, hjerte- eller hjerte-død, eller hjerneslag), heretter kalt MACE. Dette sluttpunktet skilte seg fra metaanalysenes brede sluttpunkt for myokardielle iskemiske hendelser, hvor mer enn halvparten var angina. Hjerteinfarkt inkluderte dømt dødelig og ikke-dødelig hjerteinfarkt plutselig død. Som vist i figur 2 var resultatene for de 3 sluttpunktene (MACE, MI og Total Mortality) ikke statistisk signifikant forskjellige mellom AVANDIA og komparatorer.
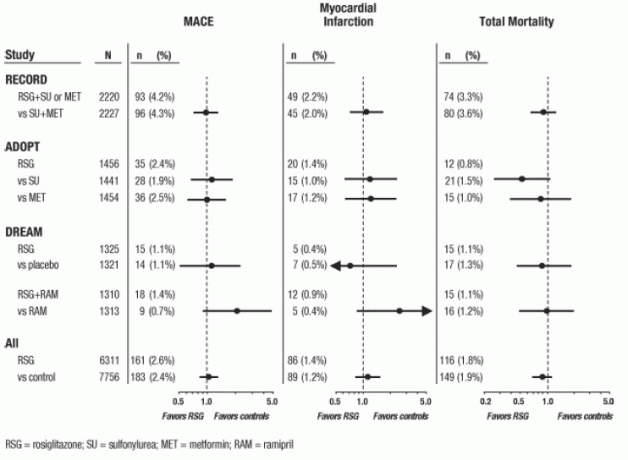
I foreløpige analyser av DREAM-studien var forekomsten av kardiovaskulære hendelser høyere blant personer som mottok AVANDIA i kombinasjon med ramipril enn blant forsøkspersoner som fikk ramipril alene, som illustrert i Figur 2. Dette funnet ble ikke bekreftet i ADOPT og RECORD (aktivt kontrollerte studier på pasienter med diabetes) der henholdsvis 30% og 40% av pasientene rapporterte om ACE-hemmer ved baseline.
I sin helhet er tilgjengelige data om risikoen for myokardiell iskemi ikke entydige. Definitive konklusjoner angående denne risikoen venter på fullføring av en tilstrekkelig utformet kardiovaskulær utfallsstudie.
Det har ikke vært noen kliniske studier som viser at det foreligger avgjørende bevis for reduksjon av makrovaskulær risiko med AVANDIA eller noe annet oralt antidiabetikum.
Kongestiv hjertesvikt og hjerteinfarkt ved samtidig administrering av AVANDIA med insulin
I studier der AVANDIA ble tilsatt insulin, økte AVANDIA risikoen for kongestiv hjertesvikt og hjerteinfarkt. (Se tabell 2.)
Samtidig administrering av AVANDIA og insulin anbefales ikke. [Se Indikasjoner og bruk og ADVARSLER OG FORHOLDSREGLER.]
I fem, 26-ukers kontrollerte, randomiserte, dobbeltblinde studier som ble inkludert i metaanalysen [se ADVARSLER OG FORHOLDSREGLER], ble pasienter med type 2 diabetes mellitus randomisert til samtidig administrering av AVANDIA og insulin (N = 867) eller insulin (N = 663). I disse 5 forsøkene ble AVANDIA tilsatt insulin. Disse forsøkene inkluderte pasienter med langvarig diabetes (median varighet på 12 år) og en høy forekomst av eksisterende medisinske tilstander, inkludert perifer nevropati, retinopati, iskemisk hjertesykdom, vaskulær sykdom og kongestivt hjerte svikt. Det totale antall pasienter med fremkommende kongestiv hjertesvikt var henholdsvis 21 (2,4%) og 7 (1,1%) i AVANDIA pluss insulin og insulingrupper. Det totale antall pasienter med fremkommende myokardiell iskemi var 24 (2,8%) og 9 (1,4%) i henholdsvis AVANDIA pluss insulin og insulingrupper (ELLER 2,1 [95% KI 0,9, 5,1]). Selv om hendelsesfrekvensen for kongestiv hjertesvikt og hjerteinfarkt var lav i de studerte befolkning, var konsentrasjonen konsekvent to ganger eller høyere ved samtidig administrering av AVANDIA og insulin. Disse kardiovaskulære hendelsene ble observert ved både 4 mg og 8 mg daglige doser av AVANDIA. (Se tabell 2.)
Tabell 2. Forekomst av kardiovaskulære hendelser i 5 kontrollerte studier av tilsetning av AVANDIA til etablert insulinbehandling
| Begivenhet* | AVANDIA + Insulin (n = 867) n (%) |
Insulin (n = 663) n (%) |
| Kongestiv hjertesvikt | 21 (2.4%) | 7 (1.1%) |
| Myokardiell iskemi | 24 (2.8%) | 9 (1.4%) |
| Sammensatt av kardiovaskulær død, hjerteinfarkt eller hjerneslag | 10 (1.2%) | 5 (0.8%) |
| Stroke | 5 (0.6%) | 4 (0.6%) |
| Hjerteinfarkt | 4 (0.5%) | 1 (0.2%) |
| Kardiovaskulær død | 4 (0.5%) | 1 (0.2%) |
| Alle dødsfall | 6 (0.7%) | 1 (0.2%) |
| * Arrangementer er ikke eksklusive; dvs. en pasient med hjerte- og karsykdom på grunn av hjerteinfarkt, vil bli talt i 4 hendelseskategorier (hjerteinfarkt; kardiovaskulær død, hjerteinfarkt eller hjerneslag; hjerteinfarkt; kardiovaskulær død). |
I en sjette, 24-ukers, kontrollert, randomisert, dobbeltblind studie av AVANDIA og samtidig administrering av insulin, ble insulin lagt til AVANDAMET® (rosiglitazonmaleat og metformin HCl) (n = 161) og sammenlignet med insulin pluss placebo (n = 158), etter en enkeltblindet 8 ukers innkjøring med Avandamet. Pasienter med ødem som trengte farmakologisk behandling og pasienter med kongestiv hjertesvikt ble ekskludert ved baseline og i løpet av innkjøringsperioden.
I gruppen som fikk AVANDAMET pluss insulin, var det en myokardiell iskemisk hendelse og en plutselig død. Ingen myokardiell iskemi ble observert i insulingruppen, og ingen kongestiv hjertesvikt ble rapportert i noen av behandlingsgruppene.
ødem
AVANDIA bør brukes med forsiktighet hos pasienter med ødem. I en klinisk studie med friske frivillige som fikk 8 mg AVANDIA en gang daglig i 8 uker, var det en statistisk signifikant økning i median plasmavolum sammenlignet med placebo.
Siden tiazolidinedioner, inkludert rosiglitazon, kan forårsake væskeansamling, noe som kan forverre eller føre til kongestiv hjertesvikt, bør AVANDIA brukes med forsiktighet hos pasienter med hjertefare svikt. Pasienter bør overvåkes for tegn og symptomer på hjertesvikt [se BOKSET ADVARSEL, ADVARSLER OG FORHOLDSREGLER ].
I kontrollerte kliniske studier av pasienter med type 2-diabetes ble mild til moderat ødem rapportert hos pasienter behandlet med AVANDIA, og kan være doserelatert. Pasienter med pågående ødem var mer sannsynlig å ha bivirkninger assosiert med ødem hvis de startet med kombinasjonsbehandling med insulin og AVANDIA [se BIVIRKNINGER].
Vektøkning
Doserelatert vektøkning ble sett med AVANDIA alene og i kombinasjon med andre hypoglykemiske midler (tabell 3). Mekanismen for vektøkning er uklar, men involverer sannsynligvis en kombinasjon av væskeansamling og fettakkumulering.
Etter markedsføring har det vært rapportert om uvanlig raske økninger i vekt og økning i overkant av det som vanligvis er observert i kliniske studier. Pasienter som opplever slike økninger, bør vurderes for væskeansamling og volumrelaterte hendelser som overdreven ødem og kongestiv hjertesvikt [se BOKSET ADVARSEL].
Tabell 3. Vektendringer (kg) fra baseline ved sluttpunktet under kliniske studier
| monoterapi | Varighet | Kontrollgruppe | Avandia 4 mg median (25., 75 persentil) |
Avandia 8 mg median (25., 75 persentil) |
|
| median (25., 75 persentil) | |||||
| 26 uker | placebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 uker | sulfonylurea | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Kombinasjonsbehandling | |||||
| sulfonylurea | 24-26 uker | sulfonylurea | 0 (-1.0, 1.3) n = 1,155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| metformin | 26 uker | metformin | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| Insulin | 26 uker | insulin | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonylurea + metformin | 26 uker | sulfonylurea + metformin | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
I en 4- til 6-årig, monoterapi, sammenlignende studie (ADOPT) hos pasienter som nylig har fått diagnosen type 2-diabetes, som ikke tidligere er blitt behandlet med antidiabetisk medisinering Clinical Studies], median vektendring (25th, 75th prosentiler) fra baseline ved 4 år var 3,5 kg (0,0, 8,1) for AVANDIA, 2,0 kg (-1,0, 4,8) for glyburid og -2,4 kg (-5,4, 0,5) for metformin.
I en 24-ukers studie på barn i alderen 10 til 17 år behandlet med AVANDIA 4 til 8 mg daglig, var en median vektøkning på 2,8 kg (25th, 75th percentiler: 0,0, 5,8) ble rapportert.
Levereffekter
Leverenzymer bør måles før behandlingen med AVANDIA påbegynnes hos alle pasienter og med jevne mellomrom etter klinisk vurdering av helsepersonellet. Behandling med AVANDIA skal ikke igangsettes hos pasienter med økte leverenzymsnivåer i baseline (ALT> 2,5X øvre normalgrense). Pasienter med lett forhøyede leverenzymer (ALT-nivåer â ¤ 2,5X øvre normalgrense) ved grunnlinjen eller under behandling med AVANDIA bør evalueres for å bestemme årsaken til leverenzymet høyde. Initiering eller fortsettelse av terapi med AVANDIA hos pasienter med milde forhøyede leverenzymer bør fortsette med forsiktighet og inkluderer tett klinisk oppfølging, inkludert overvåking av leverenzymer, for å bestemme om leverenzymet er forhøyet eller forverre. Hvis ALT-nivåene til enhver tid øker til> 3X den øvre normalgrensen hos pasienter som behandles med AVANDIA, bør leverenzymsnivåer kontrolleres så snart som mulig. Hvis ALT-nivåene forblir> 3X den øvre normalgrensen, bør behandlingen med AVANDIA seponeres.
Hvis noen pasienter utvikler symptomer som tyder på leverfunksjon, som kan inkludere uforklarlig kvalme, oppkast, magesmerter, tretthet, anoreksi og / eller mørk urin, bør leverenzymer kontrolleres. Avgjørelsen om å fortsette pasienten i behandling med AVANDIA bør styres av klinisk skjønn i påvente av laboratorieevalueringer. Hvis gulsott observeres, bør medikamentell behandling seponeres. [Se BIVIRKNINGER.]
Makulær ødem
Makulært ødem er rapportert etter markedsføring hos noen diabetespasienter som tok AVANDIA eller et annet tiazolidindion. Noen pasienter fikk uskarpt syn eller nedsatt synsstyrke, men noen pasienter ser ut til å ha blitt diagnostisert ved rutinemessig oftalmologisk undersøkelse. De fleste pasienter hadde perifert ødem på det tidspunktet makulær ødem ble diagnostisert. Noen pasienter hadde bedring i sitt makulære ødem etter seponering av tiazolidindion. Pasienter med diabetes bør ha regelmessige øyeundersøkelser av en øyelege i henhold til Standards of Care av American Diabetes Association. I tillegg bør enhver diabetiker som rapporterer noen form for visuelt symptom, omgående henvises til en øyelege, uavhengig av pasientens underliggende medisiner eller andre fysiske funn. [Se BIVIRKNINGER.]
frakturer
I en 4- til 6-årig komparativ studie (ADOPT) av glykemisk kontroll med monoterapi hos pasienter som ikke hadde medikamenter diagnostisert med diabetes mellitus type 2, ble det observert en økt forekomst av beinbrudd hos kvinnelige pasienter som tok AVANDIA. I løpet av 4-6 år var forekomsten av beinbrudd hos kvinner 9,3% (60/645) for AVANDIA mot 3,5% (21/605) for glyburid og 5,1% (30/590) for metformin. Denne økte forekomsten ble observert etter det første behandlingsåret og vedvarte i løpet av studien. Majoriteten av bruddene hos kvinnene som fikk AVANDIA forekom i overarmen, hånden og foten. Disse bruddstedene er forskjellige fra de som vanligvis er assosiert med postmenopausal osteoporose (f.eks. Hofte eller ryggrad). Det ble ikke observert noen økning i bruddraten hos menn behandlet med AVANDIA. Risikoen for brudd bør vurderes ved pleie av pasienter, spesielt kvinnelige pasienter, som er behandlet med AVANDIA, og oppmerksomhet gitt til vurdering og opprettholdelse av beinhelse i henhold til gjeldende standarder for omsorg.
Hematologiske effekter
Nedgang i gjennomsnittlig hemoglobin og hematokrit skjedde på en doserelatert måte hos voksne pasienter behandlet med AVANDIA [se BIVIRKNINGER]. De observerte endringene kan være relatert til det økte plasmavolumet som er observert ved behandling med AVANDIA.
Diabetes og blodsukkerkontroll
Pasienter som får AVANDIA i kombinasjon med andre hypoglykemiske midler kan være i faresonen for hypoglykemi, og en reduksjon i dosen av det samtidige midlet kan være nødvendig.
Periodisk faste blodsukkermålinger og HbA1c målinger bør utføres for å overvåke terapeutisk respons.
eggløsning
Terapi med AVANDIA, som andre tiazolidinedioner, kan føre til eggløsning hos noen premenopausale anovulatoriske kvinner. Som et resultat kan disse pasientene ha økt risiko for graviditet mens de tar AVANDIA [se Bruk i spesifikke befolkninger]. Dermed bør tilstrekkelig prevensjon anbefales hos kvinner før fødsel. Denne mulige effekten har ikke blitt undersøkt spesielt i kliniske studier; derfor er ikke frekvensen av denne forekomsten kjent.
Selv om hormonell ubalanse er blitt sett i prekliniske studier [se Ikke-klinisk toksikologi], er den kliniske betydningen av dette funnet ikke kjent. Hvis uventet menstruasjonsdysfunksjon oppstår, bør fordelene ved fortsatt behandling med AVANDIA vurderes.
topp
Bivirkninger
Klinisk prøveopplevelse
Voksen
I kliniske studier har omtrent 9 900 pasienter med diabetes type 2 blitt behandlet med AVANDIA.
Kortsiktige studier av AVANDIA som monoterapi og i kombinasjon med andre hypoglykemiske midler
Forekomst og typer bivirkninger rapportert i kortvarige kliniske studier av AVANDIA som monoterapi er vist i tabell 4.
Tabell 4. Bivirkninger (â € 5% i en hvilken som helst behandlingsgruppe) Rapportert av pasienter på kort sikt * Dobbeltblinde kliniske studier med AVANDIA som monoterapi
| Foretrukket termin | Avandia monoterapi N = 2,526 % |
placebo N = 601 % |
metformin N = 225 % |
Sulfonylureasâ € N = 626 % |
| Øvre luftveisinfeksjon | 9.9 | 8.7 | 8.9 | 7.3 |
| Skade | 7.6 | 4.3 | 7.6 | 6.1 |
| Hodepine | 5.9 | 5.0 | 8.9 | 5.4 |
| Ryggsmerte | 4.0 | 3.8 | 4.0 | 5.0 |
| hyperglykemi | 3.9 | 5.7 | 4.4 | 8.1 |
| Utmattelse | 3.6 | 5.0 | 4.0 | 1.9 |
| bihulebetennelse | 3.2 | 4.5 | 5.3 | 3.0 |
| Diaré | 2.3 | 3.3 | 15.6 | 3.0 |
| hypoglykemi | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Kortsiktige studier varierte fra 8 uker til 1 år. †Inkluderer pasienter som får glyburid (N = 514), gliclazide (N = 91) eller glipizid (N = 21). |
Totalt sett er typer bivirkninger uten hensyn til årsakssammenheng rapportert da AVANDIA ble brukt i kombinasjon med en sulfonylurea eller metformin var lik de under monoterapi med AVANDIA.
Hendelser med anemi og ødem hadde en tendens til å bli rapportert oftere ved høyere doser, og var generelt milde til moderate i alvorlighetsgrad og krevde vanligvis ikke seponering av behandlingen med AVANDIA.
I dobbeltblinde studier ble det rapportert anemi hos 1,9% av pasientene som fikk AVANDIA som monoterapi sammenlignet med 0,7% på placebo, 0,6% på sulfonylurea og 2,2% på metformin. Rapporter om anemi var større hos pasienter behandlet med en kombinasjon av AVANDIA og metformin (7,1%) og med en kombinasjon av AVANDIA og en sulfonylurea pluss metformin (6,7%) sammenlignet med monoterapi med AVANDIA eller i kombinasjon med en sulfonylurea (2.3%). Lavere nivåer av hemoglobin / hematokrit forbehandling hos pasienter som er registrert i metforminkombinasjonene, kan ha bidratt til høyere rapporteringshastighet for anemi i disse studiene [se BIVIRKNINGER].
I kliniske studier ble ødemer rapportert hos 4,8% av pasientene som fikk AVANDIA som monoterapi sammenlignet med 1,3% på placebo, 1,0% på sulfonylurea og 2,2% på metformin. Rapporteringshastigheten for ødem var høyere for AVANDIA 8 mg i sulfonylurea-kombinasjoner (12,4%) sammenlignet med andre kombinasjoner, med unntak av insulin. Ødem ble rapportert hos 14,7% av pasientene som fikk AVANDIA i insulinkombinasjonsforsøkene sammenlignet med 5,4% på insulin alene. Rapporter om ny begynnelse eller forverring av kongestiv hjertesvikt forekom med 1% for insulin alene, og 2% (4 mg) og 3% (8 mg) for insulin i kombinasjon med AVANDIA [se BOKSET ADVARSEL og ADVARSLER OG FORHOLDSREGLER].
I kontrollerte kombinasjonsbehandlingsstudier med sulfonylurinstoff ble milde til moderate hypoglykemiske symptomer, som ser ut til å være doserelatert, rapportert. Få pasienter ble trukket tilbake for hypoglykemi (<1%), og få episoder med hypoglykemi ble ansett for å være alvorlige (<1%). Hypoglykemi var den hyppigst rapporterte bivirkningen i faste kombinasjonsforsøk med insulin, selv om få pasienter trakk seg for hypoglykemi (4 av 408 for AVANDIA pluss insulin og 1 av 203 for insulin alene). Mengden av hypoglykemi, bekreftet med kapillær glukosekonsentrasjon i blodet - 50 mg / dL, var 6% for insulin alene og 12% (4 mg) og 14% (8 mg) for insulin i kombinasjon med AVANDIA. [Se ADVARSLER OG FORHOLDSREGLER.]
Langtidsforsøk av AVANDIA som monoterapi
En 4- til 6-årig studie (ADOPT) sammenlignet bruken av AVANDIA (n = 1.456), glyburid (n = 1.441) og metformin (n = 1.454) som monoterapi hos pasienter som nylig ble diagnostisert med diabetes type 2, som ikke tidligere ble behandlet med antidiabetika medisinering. Tabell 5 presenterer bivirkninger uten hensyn til årsakssammenheng; prisene er uttrykt per 100 pasientårseksponering (PY) for å gjøre rede for forskjellene i eksponering for studiemedisiner i de tre behandlingsgruppene.
I ADOPT ble brudd rapportert hos et større antall kvinner behandlet med AVANDIA (9,3%, 2,7 / 100 pasientår) sammenlignet med glyburid (3,5%, 1,3 / 100 pasientår) eller metformin (5,1%, 1,5 / 100 pasient-år).
De fleste bruddene hos kvinnene som fikk rosiglitazon ble rapportert i overarmen, hånden og foten. [Se ADVARSLER OG FORHOLDSREGLER.] Den observerte forekomsten av brudd for mannlige pasienter var lik blant de tre behandlingsgruppene.
Tabell 5. Bivirkninger ved terapi (â € ¥ 5 hendelser / 100 pasientår [PY]) i enhver behandlingsgruppe rapportert i en 4- til 6-årig klinisk studie av AVANDIA som monoterapi (ADOPT)
| Avandia N = 1 456 PY = 4 954 |
Glyburide N = 1 441 PY = 4 244 |
metformin N = 1,454 PY = 4.906 |
|
| nasofaryngitt | 6.3 | 6.9 | 6.6 |
| Ryggsmerte | 5.1 | 4.9 | 5.3 |
| artralgi | 5.0 | 4.8 | 4.2 |
| hypertensjon | 4.4 | 6.0 | 6.1 |
| Øvre luftveisinfeksjon | 4.3 | 5.0 | 4.7 |
| hypoglykemi | 2.9 | 13.0 | 3.4 |
| Diaré | 2.5 | 3.2 | 6.8 |
Pediatrisk
Avandia er evaluert for sikkerhet i en enkelt, aktivt kontrollert studie av barn med diabetes type 2 der 99 ble behandlet med Avandia og 101 ble behandlet med metformin. De vanligste bivirkningene (> 10%) uten hensyn til årsakssammenheng for verken Avandia eller metformin var hodepine (17% versus 14%), kvalme (4% versus 11%), nasopharyngitis (3% versus 12%), og diaré (1% versus 13%). I denne studien ble det rapportert om et tilfelle av diabetisk ketoacidose i metformingruppen. I tillegg var det 3 pasienter i rosiglitazon-gruppen som hadde FPG på 3 300 mg / dL, 2+ ketonuri og et forhøyet aniongap.
Laboratorieavvik
hematologisk
Nedgang i gjennomsnittlig hemoglobin og hematokrit forekom på doserelatert måte hos voksne pasienter som ble behandlet med Avandia (gjennomsnittlig reduksjon i individuelle studier så mye som 1,0 g / dL hemoglobin og så mye som 3,3% hematokrit). Endringene skjedde først og fremst i løpet av de første tre månedene etter påbegynt behandling av Avandia eller etter en doseøkning i Avandia. Tidsforløpet og omfanget av reduksjoner var likt hos pasienter som ble behandlet med en kombinasjon av Avandia og andre hypoglykemiske midler eller monoterapi med Avandia. Forbehandlingsnivået av hemoglobin og hematokrit var lavere hos pasienter i metforminkombinasjonsstudier og kan ha bidratt til høyere rapporteringsrate for anemi. I en enkelt studie på barn ble rapportert reduksjoner i hemoglobin og hematokrit (gjennomsnittlig reduksjon på henholdsvis 0,29 g / dL og 0,95%). Små reduksjoner i hemoglobin og hematokrit er også rapportert hos barn som er behandlet med Avandia. Antallet hvite blodlegemer gikk også noe ned hos voksne pasienter behandlet med Avandia. Nedgang i hematologiske parametere kan være relatert til økt plasmavolum observert ved behandling med Avandia.
lipider
Endringer i serumlipider er observert etter behandling med Avandia hos voksne [se Klinisk farmakologi ]. Små endringer i serumlipidparametere ble rapportert hos barn behandlet med Avandia i 24 uker.
Serumtransaminase-nivåer
I forhåndsgodkjenning kliniske studier på 4598 pasienter behandlet med Avandia (3600 eksponerte pasienterår) og i en langsiktig 4- til 6-årig studie på 1 456 pasienter behandlet med Avandia (4 954 pasientårs eksponering), var det ingen bevis for medikamentindusert levertoksisitet.
I kontroller som ble godkjent med forhåndsgodkjenning, hadde 0,2% av pasientene som ble behandlet med Avandia forhøyninger i ALT> 3X den øvre normalgrensen sammenlignet med 0,2% for placebo og 0,5% på aktive komparatorer. ALT-forhøyelsene hos pasienter behandlet med Avandia var reversible. Hyperbilirubinemia ble funnet hos 0,3% av pasientene behandlet med Avandia sammenlignet med 0,9% behandlet med placebo og 1% hos pasienter behandlet med aktive komparatorer. I kliniske studier med forhåndsgodkjenning var det ingen tilfeller av idiosynkratiske medikamentreaksjoner som førte til leversvikt. [Se Advarsler og forsiktighetsregler]
I den 4- til 6-årige ADOPT-studien ble pasienter behandlet med Avandia (4 954 eksponeringer for pasientår), glyburid (4 244 eksponering for pasientår) eller metformin (4.906 pasientårs eksponering), som monoterapi, hadde samme hastighet av ALT-økning til> 3X øvre normalgrense (0,3 per 100 pasientår eksponering).
Postmarketing-opplevelse
I tillegg til bivirkninger rapportert fra kliniske studier, er hendelsene beskrevet nedenfor identifisert under bruk av Avandia etter godkjenning. Fordi disse hendelsene rapporteres frivillig fra en populasjon av ukjent størrelse, er det ikke mulig å estimere deres hyppighet pålitelig eller alltid etablere en årsakssammenheng til medisineksponering.
Hos pasienter som får tiazolidinedionbehandling, kan potensielle alvorlige bivirkninger med eller uten dødelig utfall relatert til volumekspansjon (f.eks. congestiv hjertesvikt, lungeødem og pleural effusjoner) er rapportert [se Boxed Warning og Advarsler og forsiktighetsregler].
Det er rapporter etter markedsføring med Avandia av hepatitt, forhøyet leverenzym til 3 eller flere ganger øvre grense for normal og leversvikt med og uten dødelig utfall, selv om årsakssammenheng ikke har vært etablert.
Utslett, kløe, urticaria, angioødem, anafylaktisk reaksjon og Stevens-Johnson syndrom er rapportert sjelden.
Rapporter om ny debut eller forverret diabetisk makulær ødem med nedsatt synsskarphet er også mottatt [se Advarsler og forsiktighetsregler].
topp
Narkotikahandel
CYP2C8 Inhibitors and inducers
En hemmer av CYP2C8 (f.eks. Gemfibrozil) kan øke AUC for rosiglitazon, og en inducer av CYP2C8 (f.eks. Rifampin) kan redusere AUC for rosiglitazon. Hvis en hemmer eller en indusator av CYP2C8 startes eller stoppes under behandling med rosiglitazon, kan det derfor være behov for endringer i diabetesbehandlingen basert på klinisk respons. [Se KLINISK FARMAKOLOGI.]
topp
Bruk i spesifikke befolkninger
Svangerskap
Graviditet kategori C.
Alle svangerskap har bakgrunnsrisiko for fødselsdefekter, tap eller annet negativt resultat uavhengig av medisineksponering. Denne bakgrunnsrisikoen økes i svangerskap som er komplisert av hyperglykemi og kan reduseres med god metabolsk kontroll. Det er viktig for pasienter med diabetes eller tidligere svangerskapsdiabetes å opprettholde god metabolsk kontroll før unnfangelse og gjennom hele svangerskapet. Nøye overvåking av glukosekontroll er viktig hos slike pasienter. De fleste eksperter anbefaler at man bruker insulinmonoterapi under graviditet for å opprettholde blodsukkernivået så nær det normale som mulig.
Human data: Rosiglitazone har blitt rapportert å krysse den menneskelige morkaken og bedetectable i fostervev. Den kliniske betydningen av disse funnene er ukjent. Det er ingen tilstrekkelige og godt kontrollerte studier på gravide. AVANDIA skal ikke brukes under graviditet.
Dyrestudier: Det var ingen effekt på implantasjon eller embryoet med rosiglitazonbehandling under tidlig graviditet hos rotter, men behandling under midten av sen-svangerskapet var assosiert med fosterdød og veksthemming hos både rotter og kaniner. Teratogenisitet ble ikke observert i doser opp til 3 mg / kg hos rotter og 100 mg / kg hos kaniner (henholdsvis ca. 20 og 75 ganger human AUC ved den maksimale anbefalte humane daglige dosen). Rosiglitazone forårsaket placentapatologi hos rotter (3 mg / kg / dag). Behandling av rotter under svangerskap gjennom amming reduserte kullstørrelsen, nyføddbarhet og postnatal vekst, med veksthemning reversibel etter puberteten. For effekter på morkaken, embryo / foster og avkom var doseringen uten effekt 0,2 mg / kg / dag hos rotter og 15 mg / kg / dag hos kaniner. Disse ingen effektnivåene er omtrent 4 ganger human AUC ved den maksimale anbefalte daglige humane dosen. Rosiglitazone reduserte antall livmorimplantasjoner og levende avkom når yngre hunnrotter ble behandlet ved 40 mg / kg / dag fra 27 dagers alder til seksuell modenhet (omtrent 68 ganger human AUC på det maksimale anbefalte daglig dose). Ingen effektnivået var 2 mg / kg / dag (omtrent 4 ganger human AUC med den maksimale anbefalte daglige dosen). Det var ingen effekt på overlevelse eller vekst før fødsel.
Arbeid og levering
Effekten av rosiglitazon på fødsel og fødsel hos mennesker er ikke kjent.
Sykepleiermødre
Medikamentrelatert materiale ble påvist i melk fra lakterende rotter. Det er ikke kjent om AVANDIA skilles ut i morsmelk. Fordi mange medisiner skilles ut i morsmelk, bør AVANDIA ikke gis til en ammende kvinne.
Pediatrisk bruk
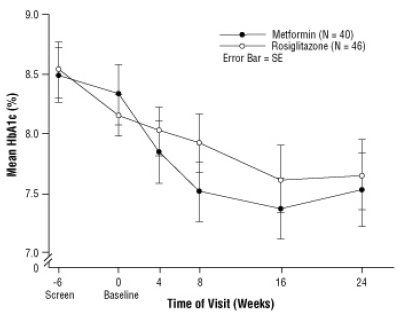
Etter placebo-innkjøring inkludert kostholdsrådgivning, barn med diabetes mellitus type 2, i alderen 10 til 17 år og med en gjennomsnittlig gjennomsnittlig kroppsmasseindeks (BMI) på 33 kg / m, ble randomisert til behandling med 2 mg to ganger daglig AVANDIA (n = 99) eller 500 mg to ganger daglig metformin (n = 101) i en 24-ukers, dobbeltblind klinisk rettssaken. Som forventet, reduserte FPG hos pasienter som ikke hadde diabetesmedisiner (n = 104) og økte hos pasienter som ble trukket fra tidligere medisiner (vanligvis metformin) (n = 90) i løpet av innkjøringsperioden. Etter minst 8 ukers behandling, hadde 49% av pasientene behandlet med AVANDIA og 55% av metforminbehandlede pasienter sin dose doblet hvis FPG> 126 mg / dL. For den generelle populasjonshensiktspopulasjonen, uke 24, var gjennomsnittlig endring fra baseline i HbA1c -0,14% med AVANDIA og -0,49% med metformin. Det var et utilstrekkelig antall pasienter i denne studien for å statistisk kunne fastslå om disse
observerte gjennomsnittlige behandlingseffekter var like eller forskjellige. Behandlingseffektene var forskjellige for pasienter som ikke har hatt behandling med antidiabetika og for pasienter som tidligere er blitt behandlet med antidiabetika (tabell 6).
Tabell 6. Uke 24 FPG og HbA1c endring fra baseline Siste observasjon ført frem hos barn med baseline HbA1c> 6,5%
| Na pasienter | Tidligere behandlede pasienter | |||
|
metformin N = 40 |
rosiglitazon N = 45 |
metformin N = 43 |
rosiglitazon N = 32 |
|
| FPG (mg / dL) | ||||
| Baseline (gjennomsnitt) | 170 | 165 | 221 | 205 |
| Endre fra baseline (gjennomsnitt) | -21 | -11 | -33 | -5 |
| Justert behandlingsforskjell * (rosiglitazon-metformin) - (95% CI) | 8 (-15, 30) |
21 (-9, 51) |
||
| % av pasienter med 30 mg / dL reduksjon fra basislinjen | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Baseline (gjennomsnitt) | 8.3 | 8.2 | 8.8 | 8.5 |
| Endre fra baseline (gjennomsnitt) | -0.7 | -0.5 | -0.4 | 0.1 |
| Justert behandlingsforskjell * (rosiglitazon-metformin) - (95% CI) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % av pasientene med 0,7% reduksjon fra grunnlinjen | 63% | 52% | 54% | 31% |
|
* Endring fra baseline-midler er minst kvadrater betyr justering for baseline HbA1c, kjønn og region. †Positive verdier for forskjellen favoriserer metformin. |
Behandlingsforskjeller var avhengig av baseline BMI eller vekt slik at effekten av AVANDIA og metformin fremsto nærmere sammenlignbare blant tyngre pasienter. Median vektøkning var 2,8 kg med rosiglitazon og 0,2 kg med metformin [se ADVARSLER OG FORHOLDSREGLER]. Femti og fire prosent av pasientene som ble behandlet med rosiglitazon og 32% av pasientene som ble behandlet med metformin fikk â 2 kg, og 33% av pasientene behandlet med rosiglitazon og 7% av pasientene behandlet med metformin fikk â € 5 kg på studere.
Bivirkninger observert i denne studien er beskrevet i bivirkninger).
Figur 3. Gjennomsnittlig HbA1c over tid i en 24-ukers studie av AVANDIA og Metformin hos pediatriske pasienter - Drug-Naïve undergruppe
Geriatrisk bruk
Resultater av populasjonens farmakokinetiske analyse viste at alder ikke påvirker farmakokinetikken til rosiglitazon signifikant [se KLINISK FARMAKOLOGI]. Derfor er ingen dosejusteringer nødvendig for eldre. I kontrollerte kliniske studier ble det ikke observert noen generelle forskjeller i sikkerhet og effektivitet mellom eldre (â € 65 år) og yngre (<65 år) pasienter.
topp
Overdosering dosering~~POS=HEADCOMP
Begrensede data er tilgjengelige med hensyn til overdosering hos mennesker. I kliniske studier på frivillige er AVANDIA administrert i en enkelt oral dose på opptil 20 mg og ble godt tolerert. I tilfelle en overdose, bør passende støttende behandling settes i gang som bestemt av pasientens kliniske status.
topp
Beskrivelse
AVANDIA (rosiglitazon maleat) er et oralt antidiabetisk middel som hovedsakelig virker ved å øke insulinfølsomheten. AVANDIA forbedrer den glykemiske kontrollen og reduserer sirkulerende insulinnivåer.
Rosiglitazon maleat er ikke kjemisk eller funksjonelt relatert til sulfonylurinstoffene, biguanidene eller alfa-glukosidaseinhibitorene.
Kjemisk er rosiglitazonmaleat (±) -5 - [[4- [2- (metyl-2-pyridinylamino) etoksy] fenyl] metyl] -2,4-tiazolidindion, (Z) -2-butendioat (1: 1) med en molekylvekt på 473,52 (357,44 fri base). Molekylet har et enkelt kiralt senter og er til stede som et racemat. På grunn av rask interkonversjon er enantiomerene funksjonelt ikke skille fra hverandre. Strukturformelen til rosiglitazonmaleat er:
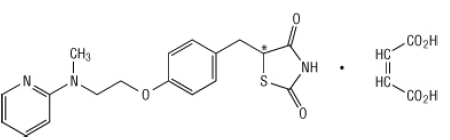
Molekylformelen er C18H19N3O3S-C4H4O4. Rosiglitazone maleat er et hvitt til off-white faststoff med et smeltepunktområde fra 122 til 123 ° C. PKa-verdiene for rosiglitazonmaleat er 6,8 og 6,1. Det er lettløselig i etanol og a bufret vandig løsning med pH på 2,3; løseligheten avtar med økende pH i det fysiologiske område.
Hver femkantede filmdrasjerte TILTAB-tablett inneholder rosiglitazonmaleat som tilsvarer rosiglitazon, 2 mg, 4 mg eller 8 mg, til oral administrering. Inaktive ingredienser er: Hypromellose 2910, laktosemonohydrat, magnesiumstearat, mikrokrystallinsk cellulose, polyetylenglykol 3000, natriumstivelsesglykolat, titandioksyd, triacetin og 1 eller flere av følgende: Syntetiske røde og gule jernoksider og talkum.
topp
Klinisk farmakologi
Virkningsmekanismen
Rosiglitazone, medlem av tiazolidinedion-klassen av antidiabetika, forbedrer glykemisk kontroll ved å forbedre insulinfølsomheten. Rosiglitazone er en svært selektiv og potent agonist for den peroksisomproliferatoraktiverte reseptor-gamma (PPARγ). Hos mennesker finnes PPAR-reseptorer i viktige målvev for insulinvirkning som fettvev, skjelettmuskulatur og lever. Aktivering av PPARγ kjernefysiske reseptorer regulerer transkripsjonen av insulin-responsive gener involvert i kontrollen av glukoseproduksjon, transport og utnyttelse. I tillegg deltar PPARγ-responsive gener også i reguleringen av fettsyremetabolismen.
Insulinresistens er et vanlig trekk som kjennetegner patogenesen til diabetes type 2. Den antidiabetiske aktiviteten til rosiglitazon er påvist i dyremodeller av type 2-diabetes i hvilken hyperglykemi og / eller nedsatt glukosetoleranse er en konsekvens av insulinresistens i målet vev. Rosiglitazone reduserer glukosekonsentrasjonen i blodet og reduserer hyperinsulinemi hos ob / ob fete mus, db / db diabetisk mus og fa / fa fet Zucker rotte.
I dyremodeller ble den antidiabetiske aktiviteten til rosiglitazon vist å være formidlet av økt følsomhet for insulinets virkning i lever-, muskel- og fettvev. Farmakologiske studier i dyremodeller indikerer at rosiglitazon hemmer glukoneogenesen i leveren. Ekspresjonen av den insulinregulerte glukosetransportøren GLUT-4 ble økt i fettvev. Rosiglitazone induserte ikke hypoglykemi i dyremodeller av type 2-diabetes og / eller nedsatt glukosetoleranse.
farmakodynamikk
Pasienter med lipidavvik ble ikke ekskludert fra kliniske studier av AVANDIA.
I alle 26-ukers kontrollerte studier, over det anbefalte doseringsområdet, var AVANDIA som monoterapi assosiert med økning i total kolesterol, LDL og HDL og reduksjon i frie fettsyrer. Disse endringene var statistisk signifikant forskjellige fra placebo- eller glyburidkontroller (tabell 7).
Økninger i LDL skjedde først og fremst i løpet av de første 1 til 2 månedene av behandlingen med AVANDIA, og LDL-nivåer forble forhøyet over grunnlinjen gjennom forsøkene. I kontrast fortsatte HDL å stige over tid. Som et resultat toppet LDL / HDL-forholdet seg etter 2 måneders behandling og så ut til å avta over tid. På grunn av den tidsmessige karakteren av lipidforandringer er den 52-ukers glyburid-kontrollerte studien mest relevant for å vurdere langtidseffekter på lipider. Ved baseline uke 26 og uke 52 var gjennomsnittlig LDL / HDL-forhold henholdsvis 3,1, 3,2 og 3,0 for AVANDIA 4 mg to ganger daglig. De tilsvarende verdiene for glyburid var 3,2, 3,1 og 2,9. Forskjellene i endring fra baseline mellom AVANDIA og glyburid i uke 52 var statistisk signifikante.
Mønsteret av endringer i LDL og HDL etter behandling med AVANDIA i kombinasjon med andre hypoglykemiske midler var generelt likt de som ble sett med AVANDIA i monoterapi.
Endringene i triglyserider under terapi med AVANDIA var varierende og var generelt ikke statistisk forskjellige fra placebo- eller glyburidkontroller.
Tabell 7. Sammendrag av gjennomsnittlige lipidendringer i 26-ukers placebokontrollert og 52-ukers Glyburid-kontrollert monoterapistudier
| Placebo-kontrollerte studier uke 26 | Glyburid-kontrollert studieuke 26 og uke 52 | ||||||
| placebo | Avandia | Glyburide Titration | AVANDIA 8 mg | ||||
| 4 mg daglig * | 8 mg daglig * | Wk 26 | Wk 52 | Wk 26 | Wk 52 | ||
| Gratis fettsyrer | |||||||
| N | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Baseline (gjennomsnitt)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Endre fra baseline (gjennomsnitt) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Baseline (gjennomsnitt)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Endre fra baseline (gjennomsnitt) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Baseline (gjennomsnitt)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Endre fra baseline (gjennomsnitt) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * En gang daglig og to ganger daglig ble doseringsgrupper kombinert. |
farmakokinetikk
Maksimal plasmakonsentrasjon (Cmax) og området under kurven (AUC) av rosiglitazon øker på en dose-proporsjonal måte over det terapeutiske doseområdet (tabell 8). Eliminasjonshalveringstiden er 3 til 4 timer og er uavhengig av dose.
Tabell 8. Gjennomsnittlige (SD) farmakokinetiske parametere for rosiglitazon etter enkle orale doser (N = 32)
| Parameter | 1 mg faste | 2 mg faste | 8 mg faste | 8 mg Fed |
| AUC0-inf [Ng-h / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [Ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Halvt liv [T] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / t] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = Oral clearance. |
absorpsjon
Den absolutte biotilgjengeligheten til rosiglitazon er 99%. Maksimal plasmakonsentrasjon observeres omtrent 1 time etter dosering. Administrering av rosiglitazon med mat resulterte ikke i noen endring i total eksponering (AUC), men det var omtrent 28% reduksjon i Cmax og en forsinkelse i Tmax (1,75 timer). Disse endringene vil sannsynligvis ikke være klinisk signifikante. derfor kan AVANDIA administreres med eller uten mat.
Fordeling
Det gjennomsnittlige (CV%) orale distribusjonsvolumet (Vss / F) av rosiglitazon er omtrent 17,6 (30%) liter, basert på en populasjonsfarmakokinetisk analyse. Rosiglitazone er omtrent 99,8% bundet til plasmaproteiner, først og fremst albumin.
metabolisme
Rosiglitazone metaboliseres i utstrakt grad uten uendret medikament som skilles ut i urinen. De viktigste metaboliseringsveiene var N-demetylering og hydroksylering, fulgt av konjugering med sulfat og glukuronsyre. Alle de sirkulerende metabolitter er betydelig mindre potente enn foreldre, og forventes derfor ikke å bidra til den insulinfølsomme aktiviteten til rosiglitazon.
In vitro-data viser at rosiglitazon hovedsakelig metaboliseres av Cytochrome P450 (CYP) isoenzym 2C8, hvor CYP2C9 bidrar som en mindre bane.
utskillelse
Etter oral eller intravenøs administrering av [14C] rosiglitazonmaleat ble omtrent 64% og 23% av dosen eliminert i henholdsvis urin og avføring. Plasmahalveringstiden for [14C] relatert materiale varierte fra 103 til 158 timer.
Befolkningsfarmakokinetikk hos pasienter med diabetes type 2
Befolkningsfarmakokinetiske analyser fra 3 store kliniske studier inkludert 642 menn og 405 kvinner med type 2-diabetes (35 år) til 80 år) viste at farmakokinetikken til rosiglitazon ikke er påvirket av alder, rase, røyking eller alkohol forbruk. Både oral clearance (CL / F) og oral steady-state distribusjonsvolum (Vss / F) ble vist å øke med økning i kroppsvekt. Over vektområdet som ble observert i disse analysene (50 til 150 kg), varierte området for predikerte CL / F- og Vss / F-verdier henholdsvis <1,7 ganger og <2,3 ganger.
I tillegg ble rosiglitazon CL / F vist å være påvirket av både vekt og kjønn, og var lavere (ca. 15%) hos kvinnelige pasienter.
Spesielle befolkninger
geriatrisk
Resultater av populasjonsfarmakokinetisk analyse (n = 716 <65 år; n = 331 â 65 år) viste at alder ikke påvirker farmakokinetikken til rosiglitazon signifikant.
Kjønn
Resultatene av populasjonsfarmakokinetikkanalysen viste at den gjennomsnittlige orale clearance av rosiglitazon i kvinnelige pasienter (n = 405) var omtrent 6% lavere sammenlignet med mannlige pasienter med samme kroppsvekt (n = 642).
Som monoterapi og i kombinasjon med metformin forbedret AVANDIA glykemisk kontroll hos både menn og kvinner. I metforminkombinasjonsstudier ble effekt påvist uten kjønnsforskjeller i glykemisk respons.
I monoterapistudier ble det observert en større terapeutisk respons hos kvinner; Hos mer overvektige pasienter var kjønnsforskjellene imidlertid mindre tydelige. For en gitt kroppsmasseindeks (BMI) har kvinner en tendens til å ha en større fettmasse enn menn. Siden det molekylære målet PPARγ kommer til uttrykk i fettvev, kan dette skilleegenskapen, i det minste delvis, forklare for den større responsen til AVANDIA hos kvinner. Siden behandlingen bør individualiseres, er det ikke nødvendig med dosejusteringer basert på kjønn alene.
Nedsatt leverfunksjon
Ubundet peroral clearance av rosiglitazon var betydelig lavere hos pasienter med moderat til alvorlig leversykdom (Child-Pugh klasse B / C) sammenlignet med friske personer. Som et resultat ble ubundet Cmax og AUC0-inf økt henholdsvis 2- og 3 ganger. Eliminasjonshalveringstiden for rosiglitazon var omtrent 2 timer lenger hos pasienter med leversykdom, sammenlignet med friske personer.
Behandling med AVANDIA skal ikke igangsettes hvis pasienten viser klinisk bevis på at det er aktivt leversykdom eller økte serumtransaminasinnivåer (ALT> 2,5X øvre normalgrense) ved utgangspunktet [se ADVARSLER OG FORHOLDSREGLER].
Pediatrisk
Farmakokinetiske parametere for rosiglitazon hos barn ble etablert ved bruk av en populasjonsfarmakokinetisk analyse med sparsomme data fra 96 pediatriske pasienter i en enkelt pediatrisk klinisk studie, inkludert 33 menn og 63 kvinner med alderen fra 10 til 17 år (vekter fra 35 til 178,3 kg). Befolkningsgjennomsnitt CL / F og V / F for rosiglitazon var henholdsvis 3,15 l / time og 13,5 l. Disse estimatene av CL / F og V / F var i samsvar med de typiske parameterestimatene fra en tidligere voksenpopulasjonsanalyse.
Nedsatt nyrefunksjon
Det er ingen klinisk relevante forskjeller i farmakokinetikken til rosiglitazon hos pasienter med milde til alvorlig nedsatt nyrefunksjon eller hos hemodialyseavhengige pasienter sammenlignet med personer med normalt nyre funksjon. Ingen dosejustering er derfor nødvendig hos slike pasienter som får AVANDIA. Siden metformin er kontraindisert hos pasienter med nedsatt nyrefunksjon, er samtidig administrering av metformin med AVANDIA kontraindisert hos disse pasientene.
Løp
Resultatene av en farmakokinetisk populasjonsanalyse inkludert individer av kaukasisk, svart og annen etnisk opprinnelse indikerer at rase ikke har noen innflytelse på farmakokinetikken til rosiglitazon.
Legemiddelinteraksjoner
Legemidler som hemmer, induserer eller blir metabolisert av Cytochrome P450
In vitro-legemiddelmetabolismestudier antyder at rosiglitazon ikke hemmer noen av de viktigste P450-enzymer i klinisk relevante konsentrasjoner. In vitro-data viser at rosiglitazon hovedsakelig metaboliseres av CYP2C8, og i mindre grad, 2C9. AVANDIA (4 mg to ganger daglig) ble vist å ikke ha noen klinisk relevant effekt på farmakokinetikken til nifedipin og orale prevensjonsmidler (etinyløstradiol og noretindrone), som hovedsakelig metaboliseres av CYP3A4.
gemfibrozil
Samtidig administrering av gemfibrozil (600 mg to ganger daglig), en hemmer av CYP2C8 og rosiglitazon (4 mg en gang daglig) i 7 dager økte AUC for rosiglitazon med 127%, sammenlignet med administrering av rosiglitazon (4 mg en gang daglig) alene. Gitt potensialet for doserelaterte bivirkninger med rosiglitazon, kan det være behov for en reduksjon i dosen med rosiglitazon når gemfibrozil blir introdusert [se NARKOTIKAHANDEL].
rifampicin
Rifampin administrering (600 mg en gang om dagen), en inducer av CYP2C8, i 6 dager rapporteres å redusere AUC for rosiglitazon med 66%, sammenlignet med administrering av rosiglitazon (8 mg) alene [se NARKOTIKAHANDEL].4
Glyburide
AVANDIA (2 mg to ganger daglig) samtidig med glyburid (3,75 til 10 mg / dag) i 7 dager endret ikke gjennomsnittlig 24-timers plasmaglukosekonsentrasjon i stabil tilstand hos diabetespasienter stabiliserte seg på glyburid terapi. Gjenta doser AVANDIA (8 mg en gang daglig) i 8 dager hos friske, voksne kaukasiske personer forårsaket en reduksjon i glyburid AUC og Cmax på omtrent 30%. Hos japanske forsøkspersoner økte AUC og Cmax for glyburid litt etter samtidig administrering av AVANDIA.
glimepirid
Enkel orale doser av glimepirid hos 14 friske voksne personer hadde ingen klinisk signifikant effekt på farmakokinetikken til AVANDIA ved stabil tilstand. Ingen klinisk signifikante reduksjoner i glimepirid AUC og Cmax ble observert etter gjentatte doser AVANDIA (8 mg en gang daglig) i 8 dager hos friske voksne personer.
metformin
Samtidig administrering av AVANDIA (2 mg to ganger daglig) og metformin (500 mg to ganger daglig) hos sunt frivillige i 4 dager hadde ingen effekt på farmakokinetikken for stabil metod for verken metformin eller rosiglitazon.
akarbose
Samtidig administrering av akarbose (100 mg tre ganger daglig) i 7 dager hos friske frivillige hadde ingen klinisk relevant effekt på farmakokinetikken til en enkelt oral dose av AVANDIA.
digoksin
Gjentatt oral dosering av AVANDIA (8 mg en gang daglig) i 14 dager forandret ikke farmakokinetikken til digoxin (0,375 mg en gang daglig) i friske tilstander.
warfarin
Gjentatt dosering med AVANDIA hadde ingen klinisk relevant effekt på farmakokinetikken for warfarinantiomerer i jevn tilstand.
etanol
En enkelt administrering av en moderat mengde alkohol økte ikke risikoen for akutt hypoglykemi hos type 2 diabetes mellitus pasienter behandlet med AVANDIA.
ranitidin
Forbehandling med ranitidin (150 mg to ganger daglig i 4 dager) forandret ikke farmakokinetikken til verken enkelt orale eller intravenøse doser rosiglitazon hos friske frivillige.
Disse resultatene antyder at absorpsjonen av oral rosiglitazon ikke endres under forhold ledsaget av økning i gastrointestinal pH.
topp
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
karsinogenese:
En 2-års karsinogenisitetsstudie ble utført i Charles River CD-1 mus i doser på 0,4, 1,5 og 6 mg / kg / dag i kostholdet (høyeste dose tilsvarer omtrent 12 ganger human AUC ved maksimalt anbefalt menneske daglig dose). Sprague-Dawley rotter ble dosert i 2 år ved oral sonde i doser på 0,05, 0,3 og 2 mg / kg / dag (høyeste dose ekvivalent til omtrent 10 og 20 ganger human AUC ved den maksimale anbefalte humane daglige dosen for hann- og hunnrotter, henholdsvis).
Rosiglitazone var ikke kreftfremkallende i musen. Det var en økning i forekomsten av fetthyperplasi hos musen i doser 1,5 mg / kg / dag (omtrent 2 ganger human AUC ved den maksimale anbefalte humane daglige dosen). Hos rotter var det en betydelig økning i forekomsten av godartede svulster i fettvev (lipomer) i doser 0,3 mg / kg / dag (omtrent 2 ganger human AUC ved den maksimale anbefalte humane daglige dosen). Disse proliferative forandringene hos begge artene vurderes på grunn av vedvarende farmakologisk overstimulering av fettvev.
mutagenese:
Rosiglitazone var ikke mutagent eller klastogent i in vitro-bakterieanalysene for genmutasjon, in vitro kromosomavvikelsestest hos humane lymfocytter, in vivo-musmikronukleustest og in vivo / in vitro rotte UDS analyse. Det var en liten (omtrent to ganger) økning i mutasjon i in vitro muselymfomanalyse i nærvær av metabolsk aktivering.
Nedsatt fruktbarhet:
Rosiglitazone hadde ingen effekter på parring eller fruktbarhet av hannrotter gitt opp til 40 mg / kg / dag (omtrent 116 ganger human AUC ved den maksimale anbefalte daglige humane dosen). Rosiglitazon endret estrisk syklus (2 mg / kg / dag) og reduserte fruktbarheten (40 mg / kg / dag) av hunnrotter i forbindelse med lavere plasmanivåer av progesteron og østradiol (ca. 20 og 200 ganger human AUC ved den maksimale anbefalte humane daglige dosen, henholdsvis). Ingen slike effekter ble observert ved 0,2 mg / kg / dag (omtrent 3 ganger human AUC ved den maksimale anbefalte daglige humane dosen). Hos unge rotter dosert fra 27 dagers alder til seksuell modenhet (ved opptil 40 mg / kg / dag) var det ingen effekt på reproduksjonsevnen hos menn, eller på estrous syklus, parringsevne eller graviditetsforekomst hos kvinner (ca. 68 ganger AUC ved maksimalt anbefalt menneske daglig dose). Hos aper ble rosiglitazon (0,6 og 4,6 mg / kg / dag; omtrent 3 og 15 ganger human AUC ved den maksimale anbefalte humane daglige dosen hhv.) reduserte follikelfasestigningen i serumøstradiol med følgelig reduksjon i bølge av luteiniserende hormon, lavere progesteronnivå i lutealfasen, og amenoré. Mekanismen for disse effektene ser ut til å være direkte hemming av steroidogenese av eggstokkene.
Dyretoksikologi
Hjertevekt ble økt hos mus (3 mg / kg / dag), rotter (5 mg / kg / dag) og hunder (2 mg / kg / dag) med rosiglitazon behandlinger (ca. 5, 22 og 2 ganger human AUC i henholdsvis den maksimale anbefalte humane dosen). Effektene hos unge rotter var i samsvar med de som ble sett hos voksne. Morfometrisk måling indikerte at det var hypertrofi i hjerteventrikkelvev, noe som kan skyldes økt hjertearbeid som et resultat av utvidelse av plasmavolum.
topp
Kliniske studier
monoterapi
I kliniske studier resulterte behandling med AVANDIA i en forbedring av glykemisk kontroll, målt ved FPG og HbA1c, med en samtidig reduksjon i insulin og C-peptid. Postprandial glukose og insulin ble også redusert. Dette er i samsvar med virkningsmekanismen til AVANDIA som insulinsensibilisator.
Maksimal anbefalt daglig dose er 8 mg. Doserekke studier antydet at det ikke ble oppnådd noen ekstra fordel med en total daglig dose på 12 mg.
Kortvarige kliniske studier: Totalt 2,315 pasienter med type 2-diabetes, tidligere behandlet med diett alene eller antidiabetika, ble behandlet med AVANDIA som monoterapi i 6 dobbeltblinde studier, som inkluderte to 26-ukers placebokontrollerte studier, en 52-ukers glyburid-kontrollert studie og 3 placebokontrollerte doserekke studier med varighet på 8 til 12 uker. Tidligere (e) antidiabetiske medisiner ble trukket tilbake og pasienter gikk inn i en 2-4 ukers placebo-innkjøringsperiode før randomisering.
To 26 ukers, dobbeltblinde, placebokontrollerte studier, hos pasienter med diabetes type 2 (n = 1 401) med utilstrekkelig glykemisk kontroll (gjennomsnittlig grunnleggende FPG ca. 228 mg / dL [101 til 425 mg / dL] og gjennomsnittlig grunnlinje HbA1c 8,9% [5,2% til 16,2%]), var gjennomført. Behandling med AVANDIA ga statistisk signifikante forbedringer i FPG og HbA1c sammenlignet med baseline og relativt til placebo. Data fra en av disse studiene er oppsummert i tabell 9.
Tabell 9: Glykemiske parametere i en 26-ukers placebokontrollert studie
| placebo N = 173 |
Avandia | Avandia | |||
| 4 mg en gang daglig N = 180 |
2 mg to ganger daglig N = 186 |
8 mg en gang daglig N = 181 |
4 mg to ganger daglig N = 187 |
||
| FPG (mg / dL) | |||||
| Baseline (gjennomsnitt) | 225 | 229 | 225 | 228 | 228 |
| Endre fra baseline (gjennomsnitt) | 8 | -25 | -35 | -42 | -55 |
| Forskjell fra placebo (justert gjennomsnitt) | - | -31* | -43* | -49* | -62* |
| % av pasienter med 30 mg / dL reduksjon fra basislinjen | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Baseline (gjennomsnitt) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Endre fra baseline (gjennomsnitt) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Forskjell fra placebo (justert gjennomsnitt) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % av pasientene med 0,7% reduksjon fra grunnlinjen | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 sammenlignet med placebo. |
Når AVANDIA ble gitt med den samme totale daglige dosen, var AVANDIA generelt mer effektiv til å redusere FPG og HbA1c når de ble administrert i delte doser to ganger daglig sammenlignet med doser en gang daglig. For HbA1c var forskjellen mellom 4 mg en gang daglig og 2 mg to ganger daglig imidlertid ikke statistisk signifikant.
Langvarige kliniske studier
Langtidsopprettholdelse av effekten ble evaluert i en 52-ukers dobbeltblind, glyburid-kontrollert studie hos pasienter med diabetes type 2. Pasientene ble randomisert til behandling med AVANDIA 2 mg to ganger daglig (N = 195) eller AVANDIA 4 mg to ganger daglig (N = 189) eller glyburid (N = 202) i 52 uker. Pasienter som fikk glyburid fikk en initial dose på 2,5 mg / dag eller 5,0 mg / dag. Doseringen ble deretter titrert i trinn på 2,5 mg / dag i løpet av de neste 12 ukene, til en maksimal dosering på 15,0 mg / dag for å optimalisere glykemisk kontroll. Deretter ble glyburid-dosen holdt konstant.
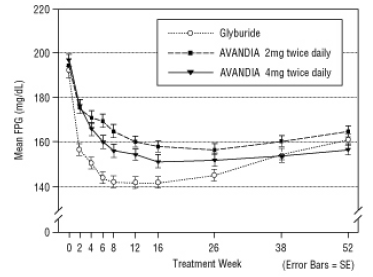
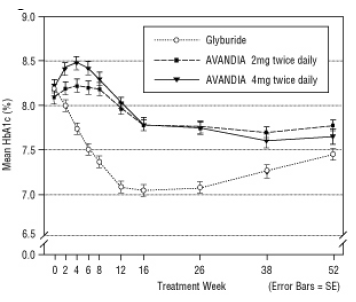
Median titrert dose glyburid var 7,5 mg. Alle behandlinger resulterte i en statistisk signifikant forbedring av glykemisk kontroll fra baseline (figur 4 og figur 5). Ved utgangen av uke 52 var reduksjonen fra baseline i FPG og HbA1c -40,8 mg / dL og -0,53% med AVANDIA 4 mg to ganger daglig; -25,4 mg / dL og -0,27% med AVANDIA 2 mg to ganger daglig; og -30,0 mg / dL og -0,72% med glyburid. For HbA1c var forskjellen mellom AVANDIA 4 mg to ganger daglig og glyburid ikke statistisk signifikant i uke 52. Det første fallet i FPG med glyburid var større enn med AVANDIA; denne effekten var imidlertid mindre holdbar over tid.
Forbedringen i glykemisk kontroll sett med AVANDIA 4 mg to ganger daglig i uke 26 ble opprettholdt gjennom uke 52 av studien.
Figur 4 Gjennomsnittlig FPG over tid i en 52-ukers Glyburid-kontrollert studie
Figur 5. Gjennomsnittlig HbA1c over tid i en 52-ukers Glyburid-kontrollert studie
Hypoglykemi ble rapportert hos 12,1% av glyburidbehandlede pasienter mot 0,5% (2 mg to ganger daglig) og 1,6% (4 mg to ganger daglig) av pasientene som ble behandlet med AVANDIA. Forbedringene i glykemisk kontroll var assosiert med en gjennomsnittlig vektøkning på 1,75 kg og 2,95 kg for pasienter behandlet med henholdsvis 2 mg og 4 mg AVANDIA to ganger daglig mot 1,9 kg i glyburidbehandlet pasienter. Hos pasienter behandlet med AVANDIA var C-peptid, insulin, pro-insulin og pro-insulin splittprodukter betydelig redusert på en doseordnet måte, sammenlignet med en økning i glyburidbehandlet pasienter.
Et Diabetes Outcome Progression Trial (ADOPT) var et multisenter, dobbeltblindt, kontrollert studie (N = 4,351) gjennomført over 4 til 6 år for å sammenligne sikkerhet og effekt av AVANDIA, metformin og glyburid-monoterapi hos pasienter som nylig har fått diagnosen type 2 diabetes mellitus (â 3)) som er utilstrekkelig kontrollert med kosthold og trening. Gjennomsnittsalderen for pasienter i denne studien var 57 år, og flertallet av pasientene (83%) hadde ingen kjent historie om hjerte- og karsykdommer. Gjennomsnittlig grunnleggende FPG og HbA1c var henholdsvis 152 mg / dL og 7,4%. Pasientene ble randomisert til å motta enten AVANDIA 4 mg en gang daglig, glyburid 2,5 mg en gang daglig, eller metformin 500 mg en gang daglig, og dosene var titrert for optimal glykemisk kontroll opp til maksimalt 4 mg to ganger daglig for AVANDIA, 7,5 mg to ganger daglig for glyburid og 1000 mg to ganger daglig for metformin. Det primære effektutfallet var tid til påfølgende FPG> 180 mg / dL etter minst 6 ukers behandling maksimalt tolerert dose studiemedisiner eller tid til utilstrekkelig glykemisk kontroll, bestemt av en uavhengig vurdering komité.
Den kumulative forekomsten av det primære effektutfallet etter 5 år var 15% med AVANDIA, 21% med metformin og 34% med glyburid (fareforhold 0,68 [95% Cl 0,55, 0,85] versus metformin, HR 0,37 [95% Cl 0,30, 0,45] versus glyburid).
Data om kardiovaskulær og bivirkning (inkludert effekter på kroppsvekt og beinbrudd) fra ADOPT for AVANDIA, metformin og glyburid er beskrevet i ADVARSLER OG FORHOLDSREGLER og BIVIRKNINGERhenholdsvis. Som med alle medisiner, må effektivitetsresultater vurderes sammen med sikkerhetsinformasjon for å vurdere potensiell fordel og risiko for en individuell pasient.
Kombinasjon med Metformin eller Sulfonylurea
Tilsetningen av AVANDIA til enten metformin eller sulfonylurea resulterte i signifikante reduksjoner i hyperglykemi sammenlignet med et av disse midlene alene. Disse resultatene stemmer overens med en additiv effekt på glykemisk kontroll når AVANDIA brukes som kombinasjonsbehandling.
Kombinasjon med Metformin
Totalt 670 pasienter med type 2-diabetes deltok i to 26-ukers, randomisert, dobbeltblind, placebo / aktiv-kontrollerte studier designet for å vurdere effekten av AVANDIA i kombinasjon med metformin. AVANDIA, administrert i en gang daglig eller to ganger daglig doseringsregimer, ble tilsatt til behandlingen av pasienter som ble utilstrekkelig kontrollert med en maksimal dose (2,5 gram / dag) metformin.
I en studie kontrollerte pasienter utilstrekkelig 2,5 gram / dag metformin (gjennomsnittlig grunnlinje FPG 216 mg / dL og gjennomsnittlig grunnlinje HbA1c 8,8%) ble randomisert til å motta 4 mg AVANDIA en gang daglig, 8 mg AVANDIA en gang daglig, eller placebo i tillegg til metformin. En statistisk signifikant bedring i FPG og HbA1c ble observert hos pasienter behandlet med kombinasjonene av metformin og 4 mg AVANDIA en gang daglig og 8 mg AVANDIA en gang daglig, kontra pasienter fortsatte med metformin alene (Tabell 10).
Tabell 10. Glykemiske parametere i en 26-ukers kombinasjonsstudie av AVANDIA Plus Metformin
| metformin N = 113 |
Avandia 4 mg en gang daglig + metformin N = 116 |
Avandia 8 mg en gang daglig + metformin N = 110 |
|
| FPG (mg / dL) | |||
| Baseline (gjennomsnitt) | 214 | 215 | 220 |
| Endre fra baseline (gjennomsnitt) | 6 | -33 | -48 |
| Forskjell fra metformin alene (justert middel) | - | -40* | -53* |
| % av pasienter med 30 mg / dL reduksjon fra basislinjen | 20% | 45% | 61% |
| HbA1c (%) | |||
| Baseline (gjennomsnitt) | 8.6 | 8.9 | 8.9 |
| Endre fra baseline (gjennomsnitt) | 0.5 | -0.6 | -0.8 |
| Forskjell fra metformin alene (justert middel) | - | -1.0* | -1.2* |
| % av pasientene med 0,7% reduksjon fra grunnlinjen | 11% | 45% | 52% |
| * p <0,0001 sammenlignet med metformin. |
I en annen 26-ukers studie undersøkte pasienter med diabetes type 2 utilstrekkelig 2,5 gram / dag metformin som ble randomisert til å få kombinasjonen AVANDIA 4 mg to ganger daglig og metformin (N = 105) viste en statistisk signifikant forbedring i glykemisk kontroll med en gjennomsnittlig behandlingseffekt for FPG på -56 mg / dL og en gjennomsnittlig behandlingseffekt for HbA1c på -0,8% over metformin alene. Kombinasjonen av metformin og AVANDIA resulterte i lavere nivåer av FPG og HbA1c enn begge midler alene.
Pasienter som ble utilstrekkelig kontrollert med en maksimal dose (2,5 gram / dag) metformin og som var det byttet til monoterapi med AVANDIA påviste tap av glykemisk kontroll, noe som fremgår av økning i FPG og HbA1c. I denne gruppen ble det også sett økninger i LDL og VLDL.
Kombinasjon med en sulfonylurea
Totalt 3.457 pasienter med type 2-diabetes deltok i ti 24- til 26-ukers randomiserte, dobbeltblinde, placebo / aktiv-kontrollerte studier og en 2-årig dobbeltblind, aktiv-kontrollert studie hos eldre pasienter designet for å vurdere effekten og sikkerheten til AVANDIA i kombinasjon med en sulfonylurea. AVANDIA 2 mg, 4 mg eller 8 mg daglig ble administrert, enten en gang daglig (3 studier) eller i delte doser to ganger daglig (7 studier), til pasienter som er utilstrekkelig kontrollert med en submaximal eller maksimal dose på sulfonylurea.
I disse studiene er kombinasjonen av AVANDIA 4 mg eller 8 mg daglig (administrert som en eller to doser daglig) og sulfonylurea reduserte signifikant FPG og HbA1c sammenlignet med placebo pluss sulfonylurea eller ytterligere opp-titrering av sulfonylurea. Tabell 11 viser samlede data for 8 studier der AVANDIA tilsatt sulfonylurea ble sammenlignet med placebo pluss sulfonylurea.
Tabell 11. Glykemiske parametere i 24- til 26-ukers kombinasjonsstudier av AVANDIA Plus Sulfonylurea
| To ganger fordelt dosering (5 studier) | sulfonylurea N = 397 |
Avandia 2 mg to ganger daglig + sulfonylurea N = 497 |
sulfonylurea N = 248 |
Avandia 4 mg to ganger daglig + sulfonylurea N = 346 |
| FPG (mg / dL) | ||||
| Baseline (gjennomsnitt) | 204 | 198 | 188 | 187 |
| Endre fra baseline (gjennomsnitt) | 11 | -29 | 8 | -43 |
| Forskjell fra sulfonylurea alene (justert gjennomsnitt) | - | -42* | - | -53* |
| % av pasienter med 30 mg / dL reduksjon fra basislinjen | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Baseline (gjennomsnitt) | 9.4 | 9.5 | 9.3 | 9.6 |
| Endre fra baseline (gjennomsnitt) | 0.2 | -1.0 | 0.0 | -1.6 |
| Forskjell fra sulfonylurea alene (justert gjennomsnitt) | - | -1.1* | - | -1.4* |
| % av pasientene med 0,7% reduksjon fra grunnlinjen | 21% | 60% | 23% | 75% |
| Dosering en gang daglig (3 studier) | sulfonylurea N = 172 |
Avandia 4 mg en gang daglig + sulfonylurea N = 172 |
sulfonylurea N = 173 |
Avandia 8 mg en gang daglig + sulfonylurea N = 176 |
| FPG (mg / dL) | ||||
| Baseline (gjennomsnitt) | 198 | 206 | 188 | 192 |
| Endre fra baseline (gjennomsnitt) | 17 | -25 | 17 | -43 |
| Forskjell fra sulfonylurea alene (justert gjennomsnitt) | - | -47* | - | -66* |
| % av pasienter med 30 mg / dL reduksjon fra basislinjen | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Baseline (gjennomsnitt) | 8.6 | 8.8 | 8.9 | 8.9 |
| Endre fra baseline (gjennomsnitt) | 0.4 | -0.5 | 0.1 | -1.2 |
| Forskjell fra sulfonylurea alene (justert gjennomsnitt) | - | -0.9* | - | -1.4* |
| % av pasientene med 0,7% reduksjon fra grunnlinjen | 11% | 36% | 20% | 68% |
| * p <0,0001 sammenlignet med sulfonylurea alene. |
En av de 24 til 26 ukers studiene inkluderte pasienter som ble utilstrekkelig kontrollert med maksimale doser av glyburid og byttet til 4 mg AVANDIA daglig som monoterapi; i denne gruppen ble tap av glykemisk kontroll påvist, noe som fremgår av økning i FPG og HbA1c.
I en 2-årig dobbeltblind studie ble eldre pasienter (i alderen 59 til 89 år) på halvmaksimum sulfonylurea (glipizid 10 mg to ganger daglig) randomisert til tilsetning av AVANDIA (n = 115, 4 mg en gang daglig til 8 mg etter behov) eller til fortsatt opp-titrering av glipizid (n = 110), til maksimalt 20 mg to ganger daglig. Gjennomsnittlig grunnleggende FPG og HbA1c var henholdsvis 157 mg / dL og 7,72% for AVANDIA pluss glipizid-armen og henholdsvis 159 mg / dL og 7,65% for glipizid-opptitreringsarmen. Tap av glykemisk kontroll (FPG - 180 mg / dL) forekom hos en betydelig lavere andel av pasientene (2%) på AVANDIA pluss glipizid sammenlignet med pasienter i glipizid-opp-titreringsarmen (28,7%). Cirka 78% av pasientene på kombinasjonsbehandling fullførte de to årene av terapi, mens bare 51% fullførte på glipizid monoterapi. Effekten av kombinasjonsbehandling på FPG og HbA1c var holdbar i løpet av den 2-årige studieperioden, med pasienter oppnå et gjennomsnitt på 132 mg / dL for FPG og et gjennomsnitt på 6,98% for HbA1c sammenlignet med ingen endring på glipizid væpne.
Kombinasjon med Sulfonylurea Plus Metformin
I to 24-til 26-ukers, dobbeltblinde, placebokontrollerte, studier designet for å vurdere effekten og sikkerheten til AVANDIA i kombinasjon med sulfonylurea pluss metformin, AVANDIA 4 mg eller 8 mg daglig, ble administrert i delte doser to ganger daglig, til pasienter som var utilstrekkelig kontrollert på submaximal (10 mg) og maksimale (20 mg) doser av glyburid og maksimal dose metformin (2) g / dag). En statistisk signifikant bedring i FPG og HbA1c ble observert hos pasienter behandlet med kombinasjonene av sulfonylurea pluss metformin og 4 mg AVANDIA og 8 mg AVANDIA versus pasienter fortsatte med sulfonylurea pluss metformin, som vist i tabell 12.
Tabell 12. Glykemiske parametere i en 26-ukers kombinasjonsstudie av AVANDIA Plus Sulfonylurea og Metformin
| Sulfonylurea + metformin N = 273 |
Avandia 2 mg to ganger daglig + sulfonylurea + metformin N = 276 |
Avandia 4 mg to ganger daglig + sulfonylurea + metformin N = 277 |
|
| FPG (mg / dL) | |||
| Baseline (gjennomsnitt) | 189 | 190 | 192 |
| Endre fra baseline (gjennomsnitt) | 14 | -19 | -40 |
| Forskjell fra sulfonylurea pluss metformin (justert gjennomsnitt) | - | -30* | -52* |
| % av pasienter med 30 mg / dL reduksjon fra basislinjen | 16% | 46% | 62% |
| HbA1c (%) | |||
| Baseline (gjennomsnitt) | 8.7 | 8.6 | 8.7 |
| Endre fra baseline (gjennomsnitt) | 0.2 | -0.4 | -0.9 |
| Forskjell fra sulfonylurea pluss metformin (justert gjennomsnitt) | - | -0.6* | -1.1* |
| % av pasientene med 0,7% reduksjon fra grunnlinjen | 16% | 39% | 63% |
| * p <0,0001 sammenlignet med placebo. |
topp
referanser
- Dokument for mat- og medikamentforvaltning. Felles møte i Endocrino Metabolic Drugs and Drug Safety and Risk Management Advisory Committee. Juli 2007.
- DREAM prøveundersøkere. Effekt av rosiglitazon på hyppigheten av diabetes hos nedsatt glukosetoleranse eller nedsatt fastende glukose: en randomisert kontroll Lancet 2006;368:1096-1105.
- Home PD, Pocock SJ, Beck-Nielsen H, et al. Rosiglitazone evaluert for kardiovaskulære utfall - en interimsanalyse. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH, et al. Effekt av rifampin på farmakokinetikken til rosiglitazon hos friske personer. Clin Pharmacol Ther 2004; 75: 157-162.
topp
Hvordan leveres / lagring og håndtering
Hver femkantede filmdrasjerte TILTAB-tablett inneholder rosiglitazon som maleat som følger: 2 mg-rosa, preget med SB på den ene siden og 2 på den andre; 4 mg-oransje, preget med SB på den ene siden og 4 på den andre; 8 mg-rødbrun, preget med SB på den ene siden og 8 på den andre.
- 2 mg flasker på 60: NDC 0029-3158-18
- 4 mg flasker med 30: NDC 0029-3159-13
- 4 mg flasker på 90: NDC 0029-3159-00
- 8 mg flasker med 30: NDC 0029-3160-13
- 8 mg flasker på 90: NDC 0029-3160-59
Oppbevares ved 25 ° C; utflukter 15 til 30 C (59 til 86 F). Dispenser i en tett, lettbestandig beholder.
sist oppdatert 02/2008
Avandia, rosiglitazonmaleat, pasientinformasjon (på vanlig engelsk)
Detaljert informasjon om tegn, symptomer, årsaker, behandling av diabetes
Informasjonen i denne monografien er ikke ment å dekke all mulig bruk, instruksjoner, forsiktighetsregler, medikamentinteraksjoner eller uheldige effekter. Denne informasjonen er generalisert og er ikke ment som spesifikk medisinsk råd. Hvis du har spørsmål om medisinene du tar eller ønsker mer informasjon, bør du kontakte lege, apotek eller sykepleier.
tilbake til:Bla gjennom alle medisiner for diabetes



