Namenda: Alzheimers medisinering
Namenda er et medisin som brukes i behandlingen av Alzheimers sykdom. Detaljert informasjon om bruk, dosering, bivirkninger av Namenda.
Merkenavn: Namenda
Generisk navn: Memantine hydrochloride
Namenda (memantinhydroklorid) er medisiner som brukes i behandling av Alzheimers sykdom. Detaljert informasjon om bruk, dosering og bivirkninger av Namenda nedenfor.
Innhold:
Beskrivelse
farmakologi
Indikasjoner og bruk
Kontra
forholdsregler
Narkotikahandel
Bivirkninger
Overdose
Dosering
Medfølgende
Pasientinstruksjoner
Namenda pasientinformasjon (på vanlig engelsk)
Beskrivelse
Namenda® (memantinhydroklorid) er en oralt aktiv NMDA-reseptorantagonist. Det kjemiske navnet på memantinhydroklorid er 1-amino-3,5-dimetyladamantanhydroklorid med følgende strukturformel:
Kilde: Forest Laboratories, U.S.-distributør eller Namenda.
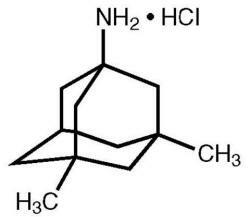
Molekylformelen er C12H21N · HCl og molekylvekten er 215,76.
Memantine HCl oppstår som et fint hvitt til off-white pulver og er løselig i vann. Namenda er tilgjengelig som tabletter eller som en oral løsning. Namenda er tilgjengelig for oral administrering som kapselformede, filmdrasjerte tabletter som inneholder 5 mg og 10 mg memantinhydroklorid. Tablettene inneholder også følgende inaktive ingredienser: mikrokrystallinsk cellulose, laktosemonohydrat, kolloidalt silisiumdioksyd, talkum og magnesiumstearat. I tillegg er følgende inaktive ingredienser også til stede som komponenter i filmfrakken: hypromellose, triacetin, titandioksid, FD&C gul # 6 og FD&C blå nr. 2 (5 mg tabletter), svart jernoksid (10 mg tabletter). Namenda oral løsning inneholder memantinhydroklorid i en styrke som tilsvarer 2 mg memantinhydroklorid i hver ml. Den orale oppløsningen inneholder også følgende inaktive ingredienser: sorbitoloppløsning (70%), metylparaben, propylparaben, propylenglykol, glyserin, naturlig peppermyntesmak nr. 104, sitronsyre, natriumcitrat og renset vann.
Klinisk farmakologi
Handlingsmekanisme og farmakodynamikk
Vedvarende aktivering av sentralnervesystemet N-metyl-D-aspartat (NMDA) reseptorer av eksitatorisk aminosyre glutamat er antatt å bidra til symptomatologien til Alzheimers sykdom. Memantine blir postulert for å utøve sin terapeutiske effekt gjennom sin virkning som en lav til moderat affinitet ikke-konkurrerende (åpen kanal) NMDA reseptor antagonist som binder fortrinnsvis til NMDA reseptor operert kationskanaler. Det er ingen bevis for at memantin forhindrer eller bremser nevrodegenerasjon hos pasienter med Alzheimers sykdom.
Memantin viste lav til ubetydelig affinitet for GABA-, benzodiazepin-, dopamin-, adrenerg-, histamin- og glycinreseptorer og for spenningsavhengige Ca 2+, Na + eller K + kanaler. Memantine viste også antagonistiske effekter ved 5HT 3-reseptoren med en styrke som tilsvarer den for NMDA-reseptoren og blokkerte nikotiniske acetylkolinreseptorer med en sjettedel til en tiendedel av potens.
In vitro-studier har vist at memantin ikke påvirker den reversible hemmingen av acetylkolinesterase av donepezil, galantamin eller takrin.
farmakokinetikk
Memantine absorberes godt etter oral administrering og har lineær farmakokinetikk over det terapeutiske doseområdet. Det skilles ut hovedsakelig i urinen, uendret, og har en terminal eliminasjonshalveringstid på ca. 60-80 timer.
Opptak og distribusjon
Etter oral administrering absorberes memantine sterkt med topp konsentrasjoner nådd på omtrent 3-7 timer. Mat har ingen effekt på absorpsjonen av memantin. Gjennomsnittlig distribusjonsvolum av memantin er 9-11 l / kg og plasmaproteinbindingen er lav (45%).
Metabolisme og eliminering
Memantine gjennomgår delvis levermetabolisme. Omtrent 48% av det administrerte medikamentet skilles ut uendret i urin; resten blir primært omdannet til tre polare metabolitter som har minimal NMDA-reseptor antagonistisk aktivitet: N-glukuronidkonjugatet, 6-hydroksy-memantin og 1-nitrosodeaminert memantin. Totalt 74% av den administrerte dosen skilles ut som summen av det overordnede medikamentet og N-glukuronidkonjugatet. Det mikrosomale enzymsystemet CYP450 i leveren spiller ikke noen vesentlig rolle i metabolismen av memantin. Memantine har en terminal eliminasjonshalveringstid på ca. 60-80 timer. Nyreclearance innebærer aktiv tubulær sekresjon moderert av pH-avhengig tubulær reabsorpsjon.
Spesielle befolkninger
Nedsatt nyrefunksjon: Farmakokinetikk for Memantine ble evaluert etter oral oral administrering av 20 mg memantine HCl hos 8 personer med mild nedsatt nyrefunksjon. (kreatininclearance, CLcr,> 50 - 80 ml / min), 8 personer med moderat nedsatt nyrefunksjon (CLcr 30 - 49 ml / min), 7 personer med alvorlig nedsatt nyrefunksjon (CLcr 5 - 29 ml / min) og 8 friske personer (CLcr> 80 ml / min) matchet så nært som mulig etter alder, vekt og kjønn til forsøkspersonene med nyre svekkelse. Gjennomsnittlig AUC 0- (uendelig) økte med 4%, 60% og 115% hos individer med henholdsvis mild, moderat og alvorlig nedsatt nyrefunksjon, sammenlignet med friske personer. Den terminale eliminasjonshalveringstiden økte med 18%, 41% og 95% hos personer med henholdsvis mild, moderat og alvorlig nedsatt nyrefunksjon, sammenlignet med friske personer.
Ingen dosejustering anbefales for pasienter med mild til moderat nedsatt nyrefunksjon. Doseringen bør reduseres hos pasienter med alvorlig nedsatt nyrefunksjon (se DOSERING OG ADMINISTRASJON).
eldre: Farmakokinetikken til Namenda hos unge og eldre personer er lik.
Kjønn: Etter administrering av multidose av Namenda 20 mg b.i.d., hadde kvinner omtrent 45% høyere eksponering enn menn, men det var ingen forskjell i eksponering når kroppsvekt ble tatt i betraktning.
Legemiddelinteraksjoner
Substrater av mikrosomale enzymer: In vitro-studier indikerte at ved konsentrasjoner som overstiger de som er assosiert med effekt, induserer ikke memantin cytokrom P450-isozymene CYP1A2, CYP2C9, CYP2E1 og CYP3A4 / 5. I tillegg har in vitro-studier vist at memantin gir minimal hemming av CYP450 enzymer CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP2E1 og CYP3A4. Disse dataene indikerer at det ikke forventes noen farmakokinetiske interaksjoner med legemidler metabolisert av disse enzymene.
Inhibitorer av mikrosomale enzymer: Siden memantin gjennomgår minimalt stoffskifte, og mesteparten av dosen skilles ut uendret i urin, er det lite sannsynlig at en interaksjon mellom memantin og medisiner som er hemmere av CYP450 enzymer. Samtidig administrering av Namenda med AChE-hemmer donepezil HCl påvirker ikke farmakokinetikken til noen av forbindelsene.
Legemidler eliminert via nyremekanismer: Memantin elimineres delvis ved tubulær sekresjon. Studier in vivo har vist at flere doser av vanndrivende hydroklortiazid / triamteren (HCTZ / TA) ikke påvirket AUC for memantin ved stabil tilstand. Memantin påvirket ikke biotilgjengeligheten til TA, og reduserte AUC og Cmax for HCTZ med omtrent 20%. Samtidig administrering av memantin og det antihyperglykemiske stoffet Glucovance® (glyburid og metformin HCl) påvirket ikke farmakokinetikken til memantin, metformin og glyburid. Memantin modifiserte ikke de glukosesenkende effektene av Glucovance®, noe som indikerte fraværet av en farmakodynamisk interaksjon.
Legemidler som gjør urinen alkalisk: Clearance av memantin ble redusert med omtrent 80% under alkaliske urinforhold ved pH 8. Derfor kan endringer i urin-pH mot alkalisk tilstand føre til en akkumulering av medikamentet med en mulig økning i uheldige effekter. Legemidler som alkaliserer urinen (f.eks. Kullsyreanhydrasinhibitorer, natriumbikarbonat) kan forventes å redusere renal eliminasjon av memantin.
Legemidler sterkt bundet til plasmaproteiner: Fordi plasmaproteinbindingen av memantin er lav (45%), er en interaksjon med medikamenter som er sterkt bundet til plasmaproteiner, som warfarin og digoxin, usannsynlig.
KLINISKE STUDIER
Effektiviteten av Namenda (memantinhydroklorid) som behandling for pasienter med moderat til alvorlig Alzheimers sykdom ble påvist i 2 randomiserte, dobbeltblinde, placebokontrollerte kliniske studier (studier 1 og 2) gjennomført i USA som vurderte både kognitiv funksjon og funksjon fra dag til dag. Gjennomsnittsalderen for pasienter som deltok i disse to forsøkene var 76 med et område på 50-93 år. Omtrent 66% av pasientene var kvinnelige og 91% av pasientene var kaukasiske.
En tredje studie (studie 3), utført i Latvia, registrerte pasienter med alvorlig demens, men vurderte ikke kognitiv funksjon som et planlagt sluttpunkt.
Studieutfallsmål: I hver amerikansk studie ble effektiviteten til Namenda bestemt ved bruk av begge instrumentene designet for å evaluere overordnet funksjon gjennom omsorgsrelatert vurdering, og et instrument som måler kognisjon. Begge studiene viste at pasienter på Namenda opplevde betydelig forbedring på begge tiltakene sammenlignet med placebo.
Den daglige funksjonen ble vurdert i begge studier ved bruk av den modifiserte Alzheimers sykdom Cooperative Study - Activity of Daily Living inventar (ADCS-ADL). ADCS-ADL består av et omfattende batteri med ADL-spørsmål som brukes til å måle funksjonsevnen til pasienter. Hver ADL-vare er rangert fra det høyeste nivået av uavhengig ytelse til fullstendig tap. Etterforskeren utfører inventaret ved å intervjue en pleier som er kjent med atferden til pasienten. En undergruppe på 19 elementer, inkludert rangeringer av pasientens evne til å spise, kle seg, bade, telefon, reise, handle, og utføre andre husarbeid, har blitt validert for vurdering av pasienter med moderat til alvorlig demens. Dette er den modifiserte ADCS-ADL, som har et scoringsområde fra 0 til 54, med de nedre score som indikerer større funksjonsnedsettelse.
Namendas evne til å forbedre kognitiv ytelse ble vurdert i begge studier med Severe Impairment Battery (SIB), en instrument med flere elementer som er validert for evaluering av kognitiv funksjon hos pasienter med moderat til alvorlig demens. SIB undersøker utvalgte aspekter ved kognitiv ytelse, inkludert elementer av oppmerksomhet, orientering, språk, hukommelse, visuospatial evne, konstruksjon, praksis og sosial interaksjon. SIB-scoringsområdet er fra 0 til 100, med lavere score som indikerer større kognitiv svikt.
Studie 1 (tjueåtte ukers studie)
I en studie på 28 ukers varighet, 252 pasienter med moderat til alvorlig sannsynlig Alzheimers sykdom (diagnostisert av DSM-IV og NINCDS-ADRDA kriterier, med Mini-Mental State Examination score> / = 3 og! - = 14 og Global Deterioration Scale Stage 5-6) ble randomisert til Namenda eller placebo. For pasienter randomisert til Namenda ble behandlingen igangsatt med 5 mg en gang daglig og økt ukentlig med 5 mg / daginndelte doser til en dose på 20 mg / dag (10 mg to ganger om dagen).
Effekter på ADCS-ADL:
Figur 1 viser tidsforløpet for endring fra baseline i ADCS-ADL-poengsum for pasienter i de to behandlingsgruppene som fullførte de 28 ukene av studien. Etter 28 ukers behandling var gjennomsnittsforskjellen i ADCS-ADL endringsresultat for Namenda-behandlede pasienter sammenlignet med pasientene på placebo 3,4 enheter. Ved bruk av en analyse basert på alle pasienter og som bar sin siste studieobservasjon videre (LOCF-analyse), var behandling med Namenda statistisk signifikant bedre enn placebo.
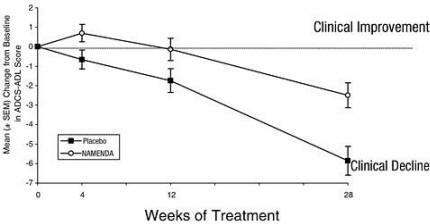
Figur 1: Tidsforløp for endringen fra baseline i ADCS-ADL-score for pasienter som fullførte 28 ukers behandling.
Figur 2 viser de kumulative prosentene av pasienter fra hver av behandlingsgruppene som hadde oppnådd minst endringen i ADCS-ADL vist på X-aksen.
Kurvene viser at både pasienter tildelt Namenda og placebo har et bredt spekter av svar og generelt viser forverring (a negativ endring i ADCS-ADL sammenlignet med baseline), men at Namenda-gruppen mer sannsynlig vil vise en mindre nedgang eller en forbedring. (I en kumulativ distribusjonsdisplay, vil en kurve for en effektiv behandling bli forskjøvet til venstre for kurven for placebo, mens en ineffektiv eller skadelig behandling ville bli lagt over eller forskjøvet til høyre for kurven for placebo).
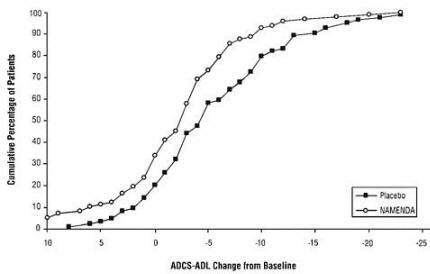
Figur 2: Kumulativ prosentandel av pasienter som fullførte 28 ukers dobbeltblind behandling med spesifiserte endringer fra baseline i ADCS-ADL-skår.
Effekter på SIB: Figur 3 viser tidsforløpet for endring fra basislinje i SIB-score for de to behandlingsgruppene i løpet av de 28 ukene av studien. Etter 28 ukers behandling var gjennomsnittlig forskjell i SIB-endringspoeng for de Namenda-behandlede pasientene sammenlignet med pasientene på placebo 5,7 enheter. Ved å bruke en LOCF-analyse var behandling med Namenda statistisk signifikant overlegen i forhold til placebo.
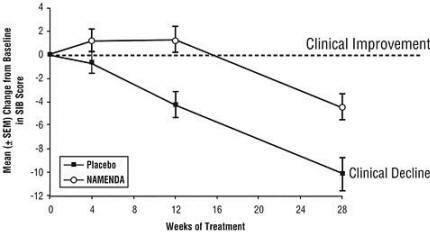
Figur 3: Tidsforløp for endring fra baseline i SIB-score for pasienter som fullførte 28 ukers behandling.
Figur 4 viser de kumulative prosentandelene av pasienter fra hver behandlingsgruppe som hadde oppnådd minst målet for endring i SIB-poengsum vist på X-aksen.
Kurvene viser at både pasienter tildelt Namenda og placebo har et bredt spekter av svar og generelt viser forverring, men at Namenda-gruppen mer sannsynlig vil vise en mindre nedgang eller forbedring.
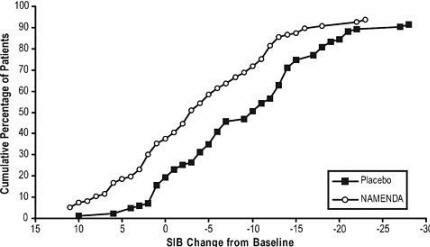
Figur 4: Kumulativ prosentandel av pasienter som fullførte 28 ukers dobbeltblind behandling med spesifiserte endringer fra baseline i SIB-skår.
Studie 2 (tjuefem ukes studie) I en studie med 24 ukers varighet, 404 pasienter med moderat til alvorlig sannsynlig Alzheimers sykdom (diagnostisert etter NINCDS-ADRDA-kriterier, med Mini-Mental State Examination) score ≥ 5 og ≤ 14) som hadde blitt behandlet med donepezil i minst 6 måneder og som hadde hatt en stabil dose på donepezil for de siste 3 månedene ble randomisert til Namenda eller placebo mens de fortsatt mottok donepezil. For pasienter randomisert til Namenda ble behandlingen igangsatt med 5 mg en gang daglig og økt ukentlig med 5 mg / dag i oppdelte doser til en dose på 20 mg / dag (10 mg to ganger om dagen).
Effekter på ADCS-ADL: Figur 5 viser tidsforløpet for endringen fra basislinjen i ADCS-ADL-poengsummen for de to behandlingsgruppene i løpet av de 24 ukene av studien. Etter 24 ukers behandling endrer gjennomsnittlig forskjell i ADCS-ADL score for Namenda / donepezil behandlede pasienter (kombinasjonsbehandling) sammenlignet med pasientene på placebo / donepezil (monoterapi) var 1,6 enheter. Ved bruk av en LOCF-analyse var Namenda / donepezil-behandlingen statistisk signifikant bedre enn placebo / donepezil.
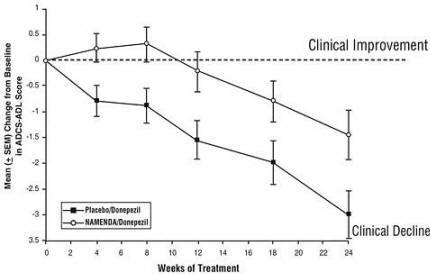
Figur 5: Tidsforløp for endringen fra baseline i ADCS-ADL-score for pasienter som fullførte 24 ukers behandling.
Figur 6 viser de kumulative prosentandelene av pasienter fra hver av behandlingsgruppene som i det minste hadde oppnådd måling av forbedring i ADCS-ADL vist på X-aksen.
Kurvene viser at både pasienter tildelt Namenda / donepezil og placebo / donepezil har et bredt spekter av svar og generelt viser forverring, men at gruppen med Namenda / donepezil mer sannsynlig viser en mindre nedgang eller forbedring.

Figur 6: Kumulativ prosentandel av pasienter som fullførte 24 ukers dobbeltblind behandling med spesifiserte endringer fra baseline i ADCS-ADL-score.
Effekter på SIB: Figur 7 viser tidsforløpet for endring fra baseline i SIB-score for de to behandlingsgruppene i løpet av de 24 ukene av studien. Etter 24 ukers behandling var gjennomsnittsforskjellen i SIB-endringspoeng for Namenda / donepezil-behandlede pasienter sammenlignet med pasientene på placebo / donepezil 3,3 enheter. Ved bruk av en LOCF-analyse var Namenda / donepezil-behandlingen statistisk signifikant bedre enn placebo / donepezil.
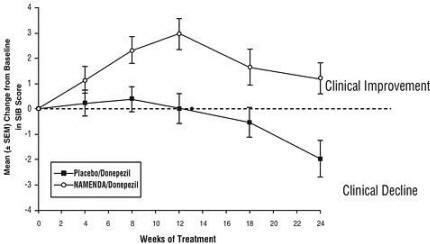
Figur 7: Tidsforløp for endringen fra baseline i SIB-score for pasienter som fullførte 24 ukers behandling.
Figur 8 viser de kumulative prosentene av pasienter fra hver behandlingsgruppe som hadde oppnådd minst målet for forbedring av SIB-poengsum vist på X-aksen.
Kurvene viser at både pasienter tildelt Namenda / donepezil og placebo / donepezil har et bredt spekter av svar, men at Namenda / donepezil-gruppen mer sannsynlig viser en forbedring eller en mindre avslå.
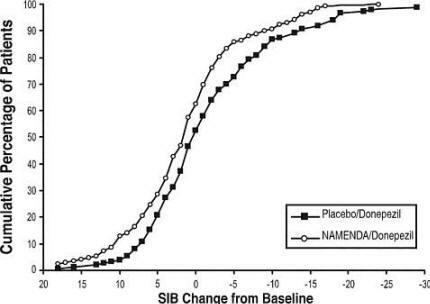
Figur 8: Kumulativ prosentandel av pasienter som fullførte 24 ukers dobbeltblind behandling med spesifiserte endringer fra baseline i SIB-skår.
Studie 3 (tolv ukers studie) I en dobbeltblind studie av 12 ukers varighet, utført på sykehjem i Latvia, 166 pasienter med demens i henhold til til DSM-III-R, en Mini-Mental State Examination score på <10 og Global Deterioration Scale-iscenesettelse på 5 til 7 ble randomisert til enten Namenda eller placebo. For pasienter randomisert til Namenda ble behandlingen igangsatt med 5 mg en gang daglig og økt til 10 mg en gang daglig etter 1 uke. De primære effektmålene var underskalaen for omsorgsavhengighet i atferdsvurderingsskalaen for geriatriske pasienter (BGP), et mål på den daglige funksjonen, og et klinisk globalt inntrykk av endring (CGI-C), et mål på den generelle kliniske effekt. Ingen gyldige mål for kognitiv funksjon ble brukt i denne studien. En statistisk signifikant behandlingsforskjell etter 12 uker som favoriserte Namenda fremfor placebo, ble sett på begge primære effektmål. Fordi pasientene som kom inn var en blanding av Alzheimers sykdom og vaskulær demens, ble det forsøkt å skille de to gruppene og alle pasienter ble senere betegnet som å ha enten vaskulær demens eller Alzheimers sykdom, basert på deres score på Hachinski Ischemic Scale ved studien inngang. Bare rundt 50% av pasientene hadde datastyrt tomografi av hjernen. For undergruppen som ble betegnet som å ha Alzheimers sykdom, ble en statistisk signifikant behandlingseffekt som favoriserte Namenda over placebo etter 12 uker, sett på både BGP og CGI-C.
Indikasjoner og bruk
Namenda (memantinhydroklorid) er indisert for behandling av moderat til alvorlig demens av Alzheimers type.
Kontra
Namenda (memantinhydroklorid) er kontraindisert hos pasienter med kjent overfølsomhet overfor memantinhydroklorid eller overfor alle hjelpestoffer som brukes i formuleringen.
forholdsregler
Informasjon til pasienter og pleiere: Omsorgspersoner skal instrueres i anbefalt administrering (to ganger per dag for doser over 5 mg) og doseutvikling (minimum intervall på en uke mellom doseøkning).
Nevrologiske forhold Anfall:
Namenda er ikke blitt systematisk evaluert hos pasienter med en anfallsforstyrrelse. I kliniske studier av Namenda forekom anfall hos 0,2% av pasientene som ble behandlet med Namenda og 0,5% av pasientene som ble behandlet med placebo.
Kjønnsbetingelser
Forhold som øker pH i urinen kan redusere urin eliminering av memantin og føre til økte plasmanivåer av memantin.
Spesielle befolkninger
Nedsatt leverfunksjon
Namenda gjennomgår delvis levermetabolisme, med omtrent 48% av den administrerte dosen skilles ut i urin som uendret legemiddel eller som summen av foreldemedisinen og N-glukuronidkonjugatet (74%). Farmakokinetikken til memantin hos pasienter med nedsatt leverfunksjon er ikke undersøkt, men forventes bare å være beskjedent påvirket.
Nedsatt nyrefunksjon
Ingen dosejustering er nødvendig hos pasienter med mild til moderat nedsatt nyrefunksjon. En dosereduksjon anbefales hos pasienter med alvorlig nedsatt nyrefunksjon (se KLINISK FARMAKOLOGI og DOSERING OG ADMINISTRASJON ).
Legemiddelinteraksjoner
N-metyl-D-aspartat (NMDA) antagonister: Den kombinerte bruken av Namenda med andre NMDA-antagonister (amantadin, ketamin og dekstrometorfan) er ikke blitt systematisk evaluert, og slik bruk bør benyttes med forsiktighet.
Effekter av Namenda på underlag av mikrosomale enzymer: In vitro-studier utført med markørsubstrater av CYP450 enzymer (CYP1A2, -2A6, -2C9, -2D6, -2E1, -3A4) viste minimal hemming av disse enzymene med memantin. I tillegg indikerer in vitro-studier at ved konsentrasjoner som overstiger de som er assosiert med effekt, induserer ikke memantin cytokrom P450-isozymene CYP1A2, CYP2C9, CYP2E1 og CYP3A4 / 5. Det forventes ingen farmakokinetiske interaksjoner med legemidler som metaboliseres av disse enzymene.
Effekter av hemmere og / eller underlag av mikrosomale enzymer på Namenda: Memantin elimineres overveiende renalt, og medisiner som er underlag og / eller hemmere av CYP450-systemet forventes ikke å endre metabolismen til memantin.
Acetylcholinesterase (AChE) -hemmere: Samtidig administrering av Namenda med AChE-hemmer donepezil HCl påvirket ikke farmakokinetikken til noen av forbindelsene. I en 24-ukers kontrollert klinisk studie på pasienter med moderat til alvorlig Alzheimers sykdom, var bivirkningen hendelsesprofil observert med en kombinasjon av memantin og donepezil var lik den for donepezil alene.
Legemidler eliminert via nyremekanismer: Fordi memantin delvis elimineres ved tubulær sekresjon, samtidig administrering av medikamenter som bruker det samme kationiske nyresystemet, inkludert hydroklortiazid (HCTZ), triamteren (TA), metformin, cimetidin, ranitidin, kinidin og nikotin, kan potensielt føre til endrede plasmanivåer av begge agenter. Samtidig administrering av Namenda og HCTZ / TA påvirket imidlertid ikke biotilgjengeligheten til verken memantin eller TA, og biotilgjengeligheten til HCTZ reduserte med 20%. I tillegg påvirket ikke samtidig medisinering av memantin og det antihyperglykemiske stoffet Glucovance® (glyburid og metformin HCl) farmakokinetikken til memantin, metformin og glyburid. Videre modifiserte ikke memantine den glukosesenkende effekten av Glucovance®.
Legemidler som gjør urinen alkalisk: Clearance av memantin ble redusert med omtrent 80% under alkaliske urinforhold ved pH 8. Derfor kan endringer i urin-pH mot den alkaliske tilstanden føre til en akkumulering av medikamentet med en mulig økning i uheldige effekter. Urin-pH endres av kosthold, medikamenter (f.eks. Karbonanhydrasehemmere, natriumbikarbonat) og pasientens kliniske tilstand (f.eks. Nyretubulær acidose eller alvorlige infeksjoner i urinveiene). Derfor bør memantin brukes med forsiktighet under disse forholdene.
Karsinogenese, mutagenese og svekkelse av fruktbarhet
Det var ingen bevis på kreftfremkallende egenskaper i en 113 ukers oral studie med mus i doser opptil 40 mg / kg / dag (10 ganger den maksimale anbefalte humane dosen [MRHD] på mg / m 2-basis). Det var heller ingen bevis for kreftfremkallende virkning hos rotter som var oralt dosert med opptil 40 mg / kg / dag i 71 uker etterfulgt av 20 mg / kg / dag (henholdsvis 20 og 10 ganger MRHD på henholdsvis mg / m 2) gjennom 128 uker.
Memantine ga ingen bevis for genotoksisk potensial ved evaluering i in vitro S. typhimurium eller E. coli omvendt mutasjonsanalyse, en in vitro kromosomal aberrasjonstest i humane lymfocytter, en in vivo cytogenetisk analyse for kromosomskade hos rotter og in vivo musmikronukleusanalyse. Resultatene var tvetydige i en in vitro-genmutasjonsanalyse ved bruk av kinesiske hamster V79-celler.
Det ble ikke sett noen svekkelse av fruktbarhet eller reproduksjonsevne hos rotter administrert opp til 18 mg / kg / dag (9 ganger MRHD på en mg / m 2 basis) muntlig fra 14 dager før parring gjennom svangerskap og amming hos kvinner, eller i 60 dager før parring i hanner.
Svangerskap
Graviditet kategori B: Memantin gitt oralt til gravide rotter og gravide kaniner i løpet av organogenesen var ikke teratogent opp til de høyeste testede dosene (18 mg / kg / dag hos rotter og 30 mg / kg / dag hos kaniner, som er henholdsvis 9 og 30 ganger den maksimale anbefalte humane dosen [MRHD] på en mg / m 2 basis).
Liten toksisitet hos mors, redusert valpevikt og økt forekomst av ikke-ossifiserte cervikale ryggvirvler ble sett ved en oral dose på 18 mg / kg / dag i en studie der rotter ble gitt oral memantin som begynte før parring og fortsatte gjennom postpartum periode. Liten mors toksisitet og redusert valpevikt ble også sett ved denne dosen i en studie der rotter ble behandlet fra svangerskapsdag 15 gjennom post-fødselsperioden. Dosen uten effekt for disse effektene var 6 mg / kg, som er 3 ganger MRHD på mg / m 2-basis.
Det er ingen tilstrekkelige og godt kontrollerte studier av memantin hos gravide. Memantine skal bare brukes under graviditet hvis den potensielle fordelen rettferdiggjør den potensielle risikoen for fosteret.
Sykepleiermødre
Det er ikke kjent om memantin skilles ut i morsmelk hos mennesker. Fordi mange medisiner skilles ut i morsmelk, bør det utvises forsiktighet når memantin administreres til en ammende mor.
Pediatrisk bruk
Det er ingen adekvate og godt kontrollerte studier som dokumenterer sikkerheten og effekten av memantin ved sykdom som oppstår hos barn.
Bivirkninger
Erfaringene beskrevet i dette avsnittet stammer fra studier på pasienter med Alzheimers sykdom og vaskulær demens.
Bivirkninger som fører til seponering: I placebokontrollerte studier der demenspasienter fikk doser av Namenda opptil 20 mg / dag, sannsynligheten for seponering på grunn av en bivirkning var den samme i Namenda-gruppen som i placebo gruppe. Ingen individuell bivirkning ble assosiert med seponering av behandlingen hos 1% eller mer av Namenda-behandlede pasienter og med en hastighet som var større enn placebo.
Bivirkninger rapportert i kontrollerte studier: De rapporterte bivirkningene i Namenda (memantinhydroklorid) -forsøk gjenspeiler erfaringene som er oppnådd under nøye overvåkte forhold i en svært valgt pasientpopulasjon. I faktisk praksis eller i andre kliniske studier kan det hende at disse frekvensestimatene ikke gjelder, ettersom betingelsene for bruk, rapporteringsatferd og hvilke typer pasienter som behandles kan variere. Tabell 1 viser symptomer og symptomer på behandling som ble rapportert hos minst 2% av pasientene i placebokontrollert demensforsøk og hvor forekomsten var større for pasienter behandlet med Namenda enn for de som ble behandlet med placebo. Ingen bivirkninger forekom med en frekvens på minst 5% og det dobbelte av placebofrekvensen.
Kroppssystem |
placebo (N = 922) % |
Namenda (N = 940) % |
Kropp som helhet | ||
Utmattelse |
1 | 2 |
Smerte |
1 | 3 |
Sirkulasjonssystem | ||
hypertensjon |
2 | 4 |
Sentralt og perifert nervesystem | ||
Svimmelhet |
5 | 7 |
Hodepine |
3 | 6 |
Mage-tarm-systemet | ||
forstoppelse |
3 | 5 |
Oppkast |
2 | 3 |
Muskel- og skjelettsystem | ||
Ryggsmerte |
2 | 3 |
Psykiatriske lidelser | ||
Forvirring |
5 | 6 |
søvnighet |
2 | 3 |
Hallusinasjon |
2 | 3 |
Luftveiene | ||
hoste |
3 | 4 |
dyspné |
1 | 2 |
Andre bivirkninger som forekom med en forekomst på minst 2% hos Namenda-behandlede pasienter, men med større eller lik hastighet på placebo, var agitasjon, fall, påført skade, urininkontinens, diaré, bronkitt, søvnløshet, urinveisinfeksjon, influensalignende symptomer, unormal ganglag, depresjon, øvre luftveisinfeksjon, angst, perifert ødem, kvalme, anoreksi og artralgi.
Den generelle profilen til bivirkninger og forekomsten av individuelle bivirkninger i underpopulasjonen av pasienter med moderat til alvorlig Alzheimers sykdom var ikke forskjellig fra profilen og forekomstene beskrevet ovenfor for den generelle demens befolkning.
Endring av vitale tegn: Namenda og placebogrupper ble sammenlignet med hensyn til (1) gjennomsnittlig endring fra baseline i vitale tegn (puls, systolisk blodtrykk, diastolisk blod trykk og vekt) og (2) forekomsten av pasienter som oppfyller kriterier for potensielt klinisk signifikante endringer fra basislinjen i disse variabler. Det var ingen klinisk viktige endringer i vitale tegn hos pasienter behandlet med Namenda. En sammenligning av rygg og stående vitale tegn for Namenda og placebo hos eldre normale personer indikerte at Namenda-behandling ikke er assosiert med ortostatiske forandringer.
Laboratorieendringer: Namenda og placebogrupper ble sammenlignet med hensyn til (1) gjennomsnittlig endring fra baseline i forskjellige serumkjemi, hematologi og urinalysevariabler og (2) forekomst av pasienter som oppfyller kriterier for potensielt klinisk signifikante endringer fra basislinjen i disse variabler. Disse analysene avdekket ingen klinisk viktige endringer i laboratorietestparametere assosiert med Namenda-behandling.
EKG-endringer: Namenda og placebogrupper ble sammenlignet med hensyn til (1) gjennomsnittlig endring fra basislinjen i forskjellige EKG-parametere og (2) forekomsten av pasienter som oppfyller kriterier for potensielt klinisk signifikante endringer fra basislinjen i disse variabler. Disse analysene avdekket ingen klinisk viktige endringer i EKG-parametere assosiert med Namenda-behandling.
Andre bivirkninger observert under kliniske studier
Namenda har blitt gitt til omtrent 1350 pasienter med demens, hvorav mer enn 1200 fikk den anbefalte maksimale dosen på 20 mg / dag. Pasientene fikk Namenda-behandling i perioder på opptil 884 dager, hvor 862 pasienter fikk minst 24 ukers behandling og 387 pasienter fikk 48 uker eller mer av behandlingen.
Behandling av fremtredende tegn og symptomer som oppstod under 8 kontrollerte kliniske studier og 4 open-label studier ble registrert som uønskede hendelser av kliniske undersøkere ved å bruke deres egne terminologier velge. For å gi et samlet estimat av andelen individer som hadde lignende typer hendelser, ble hendelsene gruppert i et mindre antall standardiserte kategorier ved bruk av WHO-terminologien, og hendelsesfrekvenser ble beregnet på tvers av alle studier.
Alle bivirkninger som forekommer hos minst to pasienter er inkludert, bortsett fra de som allerede er oppført i tabell 1, WHO-termer også generelt for å være informative, mindre symptomer eller hendelser som sannsynligvis ikke vil være medikamentell, for eksempel fordi de er vanlige i studien befolkning. Hendelser er klassifisert etter kroppssystem og listet ved hjelp av følgende definisjoner: hyppige bivirkninger - de som forekommer hos minst 1/100 pasienter; sjeldne bivirkninger - de som forekommer hos 1/100 til 1/1000 pasienter. Disse bivirkningene er ikke nødvendigvis relatert til Namenda-behandling, og i de fleste tilfeller ble det observert med samme frekvens hos placebo-behandlede pasienter i de kontrollerte studiene.
Kropp som helhet: Hyppig: synkope. Sjelden: hypotermi, allergisk reaksjon.
Sirkulasjonssystem: Hyppig: hjertesvikt. Sjelden: angina pectoris, bradykardi, hjerteinfarkt, tromboflebitis, atrieflimmer, hypotensjon, hjertestans, postural hypotensjon, lungeemboli, lungeødem.
Sentralt og perifert nervesystem: Hyppig: forbigående iskemisk angrep, cerebrovaskulær ulykke, svimmelhet, ataksi, hypokinesi. Sjelden: parestesi, kramper, ekstrapyramidal lidelse, hypertoni, skjelving, afasi, hypoestesi, unormal koordinasjon, hemiplegi, hyperkinesi, ufrivillige muskelkontraksjoner, stupor, hjerneblødning, nevralgi, ptose, nevropati.
Mage-tarm-systemet: Hyppig: gastroenteritt, divertikulitt, gastrointestinal blødning, melena, magesår, magesår.
Hemiske og lymfatiske lidelser: Hyppig: anemi. Sjelden: leukopeni.
Metabolske og ernæringssykdommer: Hyppig: økt alkalisk e-fosfatase, redusert vekt. Sjelden: dehydrering, hyponatremia, forverret diabetes mellitus.
Psykiatriske lidelser: Hyppig: aggressiv reaksjon. Sjelden: villfarelse, personlighetsforstyrrelse, emosjonell labilitet, nervøsitet, søvnforstyrrelse, økt libido, psykose, hukommelsestap, apati, paranoid reaksjon, unormal tenking, gråt abnormal, appetitt økt, paroniria, delirium, depersonalisering, nevrose, selvmord forsøk.
Luftveiene: Hyppig: lungebetennelse. Sjelden: apné, astma, hemoptyse.
Hud og appendages: Hyppig: utslett. Sjelden: hudsår, kløe, cellulitt, eksem, dermatitt, erytematøs utslett, alopecia, urticaria.
Spesielle sanser: Hyppig: grå stær, konjunktivitt. Sjelden: macula lutea degenerasjon, nedsatt synsskarphet, nedsatt hørsel, tinnitus, blefaritt, tåkesyn, hornhinnens opacitet, glaukom, konjunktivblødning, øyesmerter, netthinneblødning, xerophthalmia, diplopi, unormal lacrimation, nærsynthet, netthinneavløsning.
Urinsystem: Hyppig: hyppig micturition. Sjelden: dysuri, hematuri, urinretensjon.
Hendelser rapportert Etter markedsføring av Namenda, både USA og USA
Selv om det ikke er funnet noen årsakssammenheng med memantinbehandling, er følgende bivirkninger rapportert å være midlertidig assosiert med memantinbehandling og er ikke beskrevet andre steder i merking: atrioventrikulær blokk, beinbrudd, karpaltunnelsyndrom, hjerneinfarkt, smerter i brystet, claudication, kolitt, dyskinesi, dysfagi, gastritt, gastroøsofageal refluks, konvulsjoner i Grand Mal, intrakraniell blødning, leversvikt, hyperlipidemi, hypoglykemi, ileus, impotens, malaise, nevroleptisk malignt syndrom, akutt pankreatitt, aspirasjons lungebetennelse, akutt nyresvikt, forlenget QT-intervall, rastløshet, Stevens-Johnsons syndrom, plutselig død, supraventrikulær takykardi, takykardi, tardiv dyskinesi og trombocytopeni.
DYRE TOKSIKOLOGI
Memantin induserte nevronale lesjoner (vakuolering og nekrose) i multipolare og pyramidale celler i kortikale lag III og IV i bakre del cingulering og retrospleniale neocortices hos rotter, lignende de som er kjent for å forekomme hos gnagere som administreres av andre NMDA-reseptorantagonister. Lesjoner ble sett etter en enkelt dose memantin. I en studie der rotter ble gitt daglige orale doser av memantin i 14 dager, var doseeffekten for nevron nekrose 6 ganger den maksimale anbefalte humane dosen på mg / m 2 basis. Potensialet for induksjon av sentral neuronal vakuolering og nekrose av NMDA reseptorantagonister hos mennesker er ukjent.
MISKEMISK Misbruk og avhengighet
Kontrollert stoffklasse: Memantine HCl er ikke et kontrollert stoff.
Fysisk og psykologisk avhengighet: Memantine HCl er en lav til moderat affinitetskompetitiv NMDA-antagonist som ikke ga noen bevis for medisinsk søkende atferd eller abstinenssymptomer ved seponering hos 2 504 pasienter som deltok i kliniske studier ved terapeutisk behandling doser. Post markedsføringsdata utenfor USA, samlet i ettertid, har ikke gitt bevis for stoffmisbruk eller avhengighet.
Overdose
Fordi strategier for håndtering av overdose utvikler seg kontinuerlig, anbefales det å kontakte a giftkontrollsenter for å bestemme de siste anbefalingene for behandling av en overdose av noen legemiddel.
Som i alle tilfeller av overdose, bør generelle støttende tiltak brukes, og behandlingen bør være symptomatisk. Eliminering av memantin kan forbedres ved forsuring av urin. I et dokumentert tilfelle av en overdosering med opptil 400 mg memantin, opplevde pasienten rastløshet, psykose, visuelle hallusinasjoner, søvnighet, dumhet og bevissthetstap. Pasienten kom seg uten permanente følger.
Dosering og administrasjon
Dosen av Namenda (memantinhydroklorid) vist å være effektiv i kontrollerte kliniske studier er 20 mg / dag.
Den anbefalte startdosen av Namenda er 5 mg en gang daglig. Anbefalt måldose er 20 mg / dag. Dosen bør økes i trinn på 5 mg til 10 mg / dag (5 mg to ganger om dagen), 15 mg / dag (5 mg og 10 mg som separate doser) og 20 mg / dag (10 mg to ganger om dagen). Det anbefalte minimumsintervallet mellom doseøkninger er en uke.
Namenda kan tas med eller uten mat.
Pasienter / omsorgspersoner skal instrueres i hvordan du bruker Namenda Oral Solution doseringsenhet. De bør gjøres oppmerksom på pasientinstruksjonsarket som følger med produktet. Pasienter / omsorgspersoner skal instrueres om å stille spørsmål til bruken av løsningen til lege eller farmasøyt.
Doser i spesielle befolkninger
En målt dose på 5 mg BID anbefales til pasienter med alvorlig nedsatt nyrefunksjon (kreatininclearance på 5 - 29 ml / min basert på Cockroft-Gault-ligningen):
For menn: CLcr = [140-årsalder (år)] · Vekt (kg) / [72 · serumkreatinin (mg / dL)]
For kvinner: CLcr = 0,85 · [140-årsalder (år)] · Vekt (kg) / [72 · serumkreatinin (mg / dL)]
Hvordan leveres
5 mg tablett:
Flaske med 60 NDC # 0456-3205-60
10 × 10 enhetsdose NDC # 0456-3205-63
De kapselformede, filmbelagte tabletter er solbrune, med styrken (5) preget på den ene siden og FL på den andre.
10 mg tablett:
Flaske med 60 NDC # 0456-3210-60
10 × 10 enhetsdose NDC # 0456-3210-63
De kapselformede, filmbelagte tabletter er grå, med styrken (10) preget på den ene siden og FL på den andre.
Titration Pak:
PVC / aluminium blisterpakning som inneholder 49 tabletter. 28 × 5 mg og 21 × 10 mg tabletter. NDC # 0456-3200-14
De 5 mg kapselformede, filmbelagte tabletter er solbrune, med styrken (5) preget på den ene siden og FL på den andre. De 10 mg kapselformede, filmdrasjerte tabletter er grå, med styrken (10) preget på den ene siden og FL på den andre.
Oral løsning:
Doseringsanbefalingene for oral løsning er de samme som for tabletter. Den orale løsningen er klar, alkoholfri, sukkerfri og peppermyntsmak.
2 mg / ml oral løsning (10 mg = 5 ml)
12 fl. oz. (360 ml) flaske NDC # 0456-3202-12
Oppbevares ved 25 ° C; utflukter tillatt til 15-30 ° C (59-86 ° F) [se USP Kontrollert romtemperatur].
Forest Pharmaceuticals, Inc.
Datterselskap av Forest Laboratories, Inc.
St. Louis, MO 63045
Lisensiert fra Merz Pharmaceuticals GmbH
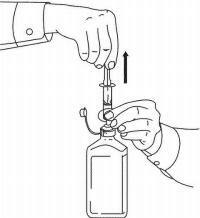
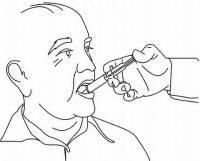
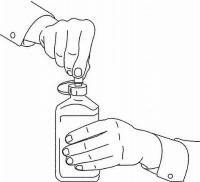
PASIENTINSTRUKSJONER FOR NAMENDA® oral løsning
Følg instruksjonene nedenfor for å bruke din Namenda® Oral Solution doseringsenhet.
VIKTIG: Les disse instruksjonene før du bruker Namenda® Oral Solution.
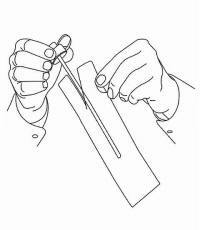 |
|
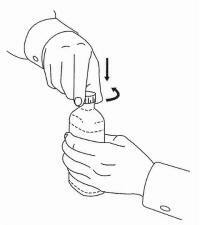 |
|
 |
|
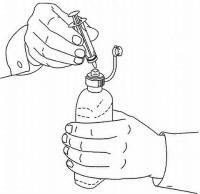 |
|
 |
|
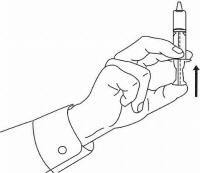 |
|
 |
|
 |
|
 |
|
 |
|
VIKTIG: Informasjonen i denne monografien er ikke ment å dekke all mulig bruk, anvisninger, forsiktighetsregler, medikamentinteraksjoner eller uheldige effekter. Denne informasjonen er generalisert og er ikke ment som spesifikk medisinsk råd. Hvis du har spørsmål om medisinene du tar eller ønsker mer informasjon, bør du kontakte lege, apotek eller sykepleier. Sist oppdatert 4/07.
Kilde: Forest Laboratories, USA-distributør av Namenda.
Namenda pasientinformasjon (på vanlig engelsk)
tilbake til: Psykiatriske medisiner Farmakologisk hjemmeside



