Glyset for behandling av diabetes
Merkenavn: Glyset
Generisk navn: Miglitol
Innhold:
Beskrivelse
Klinisk farmakologi
Kliniske studier
Indikasjoner og bruk
Kontra
forholdsregler
Bivirkninger
Overdosering dosering~~POS=HEADCOMP
Dosering og administrasjon
Hvordan leveres
Glyset, miglitol, pasientinformasjon (på vanlig engelsk)
Beskrivelse
GLYSET tabletter inneholder miglitol, en oral alpha-glukosidase-hemmer for bruk i behandling av ikke-insulinavhengig diabetes mellitus (NIDDM). Miglitol er et desoksynojirimycinderivat, og er kjemisk kjent som 3,4,5-piperidinetriol, 1- (2-hydroksyetyl) -2- (hydroksymetyl) -, [2R- (2Î ±, 3β, 4Î ±, 5β)] -. Det er et hvitt til blekgult pulver med en molekylvekt på 207,2. Miglitol er løselig i vann og har en pKa på 5,9. Den empiriske formelen er C8H17NO5 og dens kjemiske struktur er som følger:
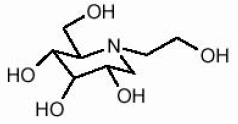
GLYSET er tilgjengelig som 25 mg, 50 mg og 100 mg tabletter til oral bruk. De inaktive ingrediensene er stivelse, mikrokrystallinsk cellulose, magnesiumstearat, hypromellose, polyetylenglykol, titandioksyd og polysorbat 80.
topp
Klinisk farmakologi
Miglitol er et desoxynojirimycin-derivat som forsinker fordøyelsen av inntatt karbohydrater, og dermed resulterer i en mindre økning i blodsukkerkonsentrasjonen etter måltider. Som en konsekvens av glukosereduksjon i plasma reduserer GLYSET tabletter nivåene av glykosylert hemoglobin hos pasienter med type II (ikke-insulinavhengig) diabetes mellitus. Systemisk ikke-enzymatisk proteinglykosylering, reflektert av nivåer av glykosylert hemoglobin, er en funksjon av gjennomsnittlig blodsukkerkonsentrasjon over tid.
Virkningsmekanismen
I motsetning til sulfonylurea, forbedrer GLYSET ikke insulinutskillelsen. Den antihyperglykemiske virkningen av miglitol er resultatet av en reversibel hemming av membranbundne tarm Î ± -glukosidhydrolaseenzymer. Membranbundet tarm Î ± -glukosidaser hydrolyserer oligosakkarider og disakkarider til glukose og andre monosakkarider i børstegrensen til tynntarmen. Hos diabetespasienter resulterer denne enzymhemming i forsinket glukoseabsorpsjon og senking av postprandial hyperglykemi.
Fordi dens virkningsmekanisme er forskjellig, er effekten av GLYSET for å forbedre glykemisk kontroll tilsetning til sulfonylurinstoffene når den brukes i kombinasjon. I tillegg reduserer GLYSET de insulinotropiske og vektøkende effektene av sulfonylurea.
Miglitol har liten hemmende aktivitet mot laktase, og i de anbefalte dosene forventes det derfor ikke å indusere laktoseintoleranse.
farmakokinetikk
absorpsjon
Absorpsjon av miglitol er mettet ved høye doser: en dose på 25 mg absorberes fullstendig, mens en dose på 100 mg bare er 50% - 70% absorbert. For alle doser oppnås toppkonsentrasjoner på 2-3 timer. Det er ingen bevis for at systemisk absorpsjon av miglitol bidrar til den terapeutiske effekten.
Fordeling
Proteinbindingen til miglitol er ubetydelig (<4,0%). Miglitol har et distribusjonsvolum på 0,18 L / kg, konsistent med distribusjon primært i den ekstracellulære væsken.
metabolisme
Miglitol metaboliseres ikke hos mennesker eller i noen dyrearter som er studert. Ingen metabolitter er blitt påvist i plasma, urin eller avføring, noe som indikerer mangel på systemisk eller pre-systemisk metabolisme.
utskillelse
Miglitol elimineres ved renal utskillelse som uendret legemiddel. Etter en 25 mg dose utvinnes over 95% av dosen i urinen i løpet av 24 timer. Ved høyere doser er den kumulative utvinning av medikament fra urin noe lavere på grunn av ufullstendig biotilgjengelighet. Eliminasjonshalveringstiden for miglitol fra plasma er omtrent 2 timer.
Spesielle befolkninger
Nedsatt nyrefunksjon
Fordi miglitol først skilles ut av nyrene, forventes det ansamling av miglitol hos pasienter med nedsatt nyrefunksjon. Pasienter med kreatininclearance 60 ml / min. Dosjustering for å korrigere de økte plasmakonsentrasjonene er ikke mulig fordi miglitol virker lokalt. Lite informasjon er tilgjengelig om sikkerheten til miglitol hos pasienter med kreatininclearance <25 ml / min.
Nedsatt leverfunksjon
Farmakokinetikken til Miglitol ble ikke endret hos cirrhotiske pasienter i forhold til friske kontrollpersoner. Siden miglitol ikke metaboliseres, forventes ingen påvirkning av leverfunksjonen på kinetikken til miglitol.
Kjønn
Ingen signifikant forskjell i farmakokinetikken til miglitol ble observert mellom eldre menn og kvinner når man tok hensyn til kroppsvekt.
Løp
Flere farmakokinetiske studier ble utført hos japanske frivillige, med resultater som ligner de som ble observert hos kaukasiere. En studie som sammenlignet den farmakodynamiske responsen på en enkelt dose på 50 mg hos svarte og hvite friske frivillige indikerte lignende glukose- og insulinrespons i begge populasjoner.
topp
Kliniske studier
Klinisk erfaring med ikke-insulinavhengig diabetes mellitus (NIDDM) pasienter kun på diettbehandling
GLYSET tabletter ble evaluert i to amerikanske og tre ikke-U.S.-kontrollerte, faste doser, monoterapistudier, hvor 735 pasienter behandlet med GLYSET ble evaluert for effektanalyser (se tabell 1).
I studie 1, en ettårsstudie der GLYSET ble evaluert som monoterapi og også som kombinasjonsbehandling, var det en statistisk signifikant mindre økning i gjennomsnittlig glykosylert hemoglobin (HbA1c) over tid i miglitol 50 mg 3 ganger daglig monoterapi-arm sammenlignet til placebo. Betydelige reduksjoner i gjennomsnittlig faste og postprandial glukose i plasma og i gjennomsnittlig postprandial insulinnivå ble observert hos pasienter behandlet med GLYSET sammenlignet med placebogruppen.
I studie 2, en 14-ukers studie, var det en signifikant reduksjon i HbA1c hos pasienter som fikk GLYSET 50 mg 3 ganger daglig eller 100 mg 3 ganger daglig sammenlignet med placebo. I tillegg var det signifikante reduksjoner i postprandial plasmaglukose og postprandial seruminsulinnivå sammenlignet med placebo.
Studie 3 var en 6-måneders dose-varierende studie som evaluerte GLYSET i doser fra 25 mg 3 ganger daglig til 200 mg 3 ganger daglig. GLYSET ga en større reduksjon i HbA1c enn placebo i alle doser, selv om effekten bare var statistisk signifikant ved 100 mg 3 ganger daglig og 200 mg 3 ganger daglig. I tillegg ga alle doser av GLYSET signifikante reduksjoner i glukose etter plasma og postprandial insulinnivå sammenlignet med placebo.
Studiene 4 og 5 var 6-måneders studier som evaluerte henholdsvis 50 og 100 mg 3 ganger daglig og 100 mg 3 ganger daglig. Sammenlignet med placebo produserte GLYSET signifikante reduksjoner i HbA1c, så vel som en betydelig reduksjon i postprandial plasmaglukose i begge studier i dosene som ble brukt.
Tabell 1 Resultater av monoterapistudie med Glyset
| Studere | Behandling | HbA1c (%) | 1 times postprandial glukose (mg / dL) | |
| Gjennomsnittlig endring fra grunnlinjen * | Behandlingseffekt ** | Gjennomsnittlig endring fra grunnlinjen | Behandlingseffekt ** | |
| 1 (U.S.) | placebo | +0.71 | +24 | |
| GLYSET 50 mg t.i.d. *** | +0.13 | -0.58†| -39 | -63†|
| 2 (U.S.) | placebo | +0.47 | +15 | |
| GLYSET 50 mg t.i.d. | -0.22 | -0.69†| -52 | -67†|
| GLYSET 100 mg t.i.d. | -0.28 | -0.75†| -59 | -74†|
| 3 (ikke-amerikansk) | placebo | +0.18 | +2 | |
| GLYSET 25 mg t.i.d. | -0.08 | -0.26 | -33 | -35†|
| GLYSET 50 mg t.i.d. | -0.22 | -0.40 | -45 | -47†|
| GLYSET 100 mg t.i.d. | -0.63 | -0.81†| -62 | -64†|
| GLYSET 200 mg t.i.d.c | -0.84 | -1.02†| -85 | -87†|
| 4 (ikke-amerikansk) | placebo | +0.01 | +8 | |
| GLYSET 50 mg t.i.d. | -0.35 | -0.36†| -20 | -28†|
| GLYSET 100 mg t.i.d. | -0.57 | -0.58†| -25 | -33†|
| 5 (ikke-amerikansk) | placebo | +0.32 | +17 | |
| GLYSET 100 mg t.i.d. | -0.43 | -0.75†| -38 | -55†|
| * Gjennomsnittlig grunnlinje varierte fra 7,54 til 8,72% i disse studiene. ** Resultatet av å trekke gjennomsnittet av placebogruppen. *** t.i.d. = 3 ganger daglig †p â ‰ ¤ 0,05 c Selv om resultatene for 200 mg 3 ganger daglig presenteres for fullstendighet, er den maksimale anbefalte doseringen av GLYSET 100 mg 3 ganger daglig. |
Klinisk erfaring hos NIDDM-pasienter som mottar sulfonylurea
GLYSET ble studert som tilleggsbehandling mot en bakgrunn av maksimal eller nesten maksimal sulfonylurea (SFU) behandling i tre store, dobbeltblinde, randomiserte studier (to U.S. og en ikke-U.S.) der 471 pasienter behandlet med GLYSET ble evaluert for effekt (se Tabell 2).
Studie 6 inkluderte pasienter som ble behandlet med maksimale doser SFU ved innreise. På slutten av denne 14-ukers studien var den gjennomsnittlige behandlingseffekten på glykosylert hemoglobin (HbA1c) -0,82% og -0,74% for pasienter som får GLYSET 50 mg 3 ganger daglig pluss SFU, og GLYSET 100 mg 3 ganger daglig pluss SFU, henholdsvis.
Studie 7 var en ettårig studie der GLYSET ved 25, 50 eller 100 mg 3 ganger daglig ble tilsatt til en maksimal dose glyburid (10 mg to ganger daglig). Ved slutten av denne studien ble middelbehandlingseffekten på HbA1c av GLYSET når det ble tilsatt maksimalt glyburid terapi var -0,30%, -0,62% og -0,73% med 25, 50 og 100 mg 3 ganger daglig doser av GLYSET, henholdsvis.
I studie 8 ga tilsetningen av GLYSET 100 mg 3 ganger daglig til en bakgrunn av behandling med glyburid en ekstra gjennomsnittlig behandlingseffekt på HbA1c på -0,66%.
Tabell 2: Resultater av kombinasjonsbehandling med GLYSET Plus Sulfonylurea (SFU)
| Studere | Behandling | HbA1c (%) | 1 times postprandial glukose (mg / dL) | |
| Gjennomsnittlig endring fra grunnlinjen * | Behandlingseffekt ** | Gjennomsnittlig endring fra grunnlinjen | Behandlingseffekt ** | |
| 6 (U.S.) | Placebo + SFU | +0.33 | -1 | |
| GLYSET 50 mg t.i.d. *** + SFU | -0.49 | -0.82†| -69 | -68†|
| GLYSET 100 mg t.i.d. + SFU | -0.41 | -0.74†| -73 | -72†|
| 7 (U.S.) | Placebo + SFU | +1.01 | 48 | |
| GLYSET 25 mg t.i.d. + SFU | +0.71 | -0.30 | -2 | -50†|
| GLYSET 50 mg t.i.d. + SFU | +0.39 | -0.62†| -13 | -61†|
| GLYSET 100 mg t.i.d. + SFU | +0.28 | -0.73†| -33 | -81†|
| 8 (ikke-amerikansk) | Placebo + SFU | +0.16 | +10 | |
| GLYSET 100 mg t.i.d. + SFU | -0.50 | -0.66†| -36 | -46†|
| * Gjennomsnittlig grunnlinje varierte fra 8,56 til 9,16% i disse studiene. ** Resultatet av å trekke gjennomsnittet av placebogruppen. *** t.i.d. = 3 ganger daglig â € p â 0,05 |
Dose-respons
Resultater fra kontrollerte, faste dosestudier av Glyset som monoterapi eller som kombinasjonsbehandling med sulfonylurea ble kombinert for å utlede et samlet estimat av forskjellen fra placebo i gjennomsnittlig endring fra baseline i glykosylert hemoglobin (HbA1c) og postprandial plasmaglukose som vist i figur 1 og 2:
Figur 1: HbA1c (%) Gjennomsnittlig endring fra baseline: Behandlingseffekt Samlede resultater fra kontrollerte faste doser i tabeller 1 og 2

Figur 2: 1-timers postprandial glukose i plasma Gjennomsnittlig endring fra baseline: Behandlingseffekt Samlede resultater fra kontrollerte faste doser i tabeller 1 og 2
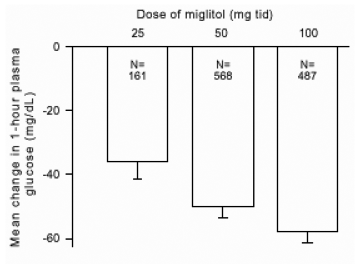
På grunn av dens virkningsmekanisme manifesteres den primære farmakologiske effekten av miglitol som en reduksjon i postprandial plasmaglukose, som tidligere vist i alle de viktigste kliniske forsøkene. GLYSET var statistisk signifikant forskjellig fra placebo ved alle doser i hver av de individuelle studiene med hensyn til effekt gjennomsnittlig en times postprandial plasmaglukose, og det er en doserespons fra 25 til 100 mg 3 ganger daglig for denne effekten parameter.
topp
Indikasjoner og bruk
Glyset tabletter, som monoterapi, er indikert som et supplement til kostholdet for å forbedre glykemisk kontroll i pasienter med ikke-insulinavhengig diabetes mellitus (NIDDM) hvis hyperglykemi ikke kan håndteres med kosthold alene. Glyset kan også brukes i kombinasjon med en sulfonylurea når diett pluss enten Glyset eller en sulfonylurea alene ikke resulterer i tilstrekkelig glykemisk kontroll. Effekten av Glyset for å forbedre den glykemiske kontrollen er additiv til sulfonylurea når den brukes i kombinasjon, antagelig fordi dens virkningsmekanisme er forskjellig.
Ved igangsetting av behandling for NIDDM, bør kosthold vektlegges som den primære behandlingsformen. Kalorirestriksjon og vekttap er essensielt hos den overvektige diabetespasienten. Riktig kostholdsbehandling alene kan være effektiv for å kontrollere blodsukker og symptomer på hyperglykemi. Viktigheten av regelmessig fysisk aktivitet når det er aktuelt, bør også understrekes. Hvis dette behandlingsprogrammet ikke resulterer i tilstrekkelig glykemisk kontroll, bør bruk av Glyset vurderes. Bruk av Glyset må sees av både lege og pasient som en behandling i tillegg til kosthold og ikke som en erstatning for kosthold eller som en praktisk mekanisme for å unngå kostholdsbeherskelse.
topp
Kontra
GLYSET tabletter er kontraindisert hos pasienter med:
- Diabetisk ketoacidose
- Inflammatorisk tarmsykdom, tykktarmsår, eller delvis tarmhindring, og hos pasienter som er disponert for tarmhindring
- Kroniske tarmsykdommer assosiert med markerte forstyrrelser i fordøyelsen eller absorpsjonen, eller med tilstander som kan forringes som følge av økt gassdannelse i tarmen
- Overfølsomhet overfor stoffet eller noen av komponentene.
topp
forholdsregler
Generell
hypoglykemi
På grunn av sin virkningsmekanisme, bør GLYSET når den administreres alene ikke forårsake hypoglykemi i fastende eller postprandial tilstand. Sulfonylurea-midler kan forårsake hypoglykemi. Fordi GLYSET tabletter gitt i kombinasjon med sulfonylurea vil føre til en ytterligere senking av blodsukkeret, det kan øke det hypoglykemiske potensialet til sulfonylurea, selv om dette ikke ble observert klinisk studier. Oral glukose (dekstrose), hvis absorpsjon ikke er forsinket av GLYSET, bør brukes i stedet for sukrose (rørsukker) til behandling av mild til moderat hypoglykemi. Sukrose, hvis hydrolyse til glukose og fruktose er hemmet av GLYSET, er uegnet for hurtig korreksjon av hypoglykemi. Alvorlig hypoglykemi kan kreve bruk av intravenøs glukoseinfusjon eller glukagoninjeksjon.
Tap av kontroll av blodsukker
Når diabetespasienter blir utsatt for stress som feber, traumer, infeksjoner eller kirurgi, kan et midlertidig tap av kontroll over blodsukkeret oppstå. På slike tider kan midlertidig insulinbehandling være nødvendig.
Nedsatt nyrefunksjon
Plasmakonsentrasjoner av GLYSET hos nedsatt nedsatt frivillig ble proporsjonalt økt i forhold til graden av nedsatt funksjonsevne. Langvarige kliniske studier hos diabetespasienter med betydelig nyrefunksjon (serumkreatinin> 2,0 mg / dL) er ikke utført. Derfor anbefales ikke behandling av disse pasientene med GLYSET.
Informasjon til pasienter
Følgende informasjon skal gis til pasienter:
- Glyset bør tas oralt tre ganger om dagen i starten (med den første bitt) av hvert hovedmåltid. Det er viktig å fortsette å følge kostholdsinstruksjonene, et regelmessig treningsprogram og regelmessig testing av urin og / eller blodsukker.
- Glyset i seg selv forårsaker ikke hypoglykemi selv når den gis til pasienter i fastende tilstand. Sulfonylurea medisiner og insulin kan imidlertid senke blodsukkernivået nok til å forårsake symptomer eller noen ganger livstruende hypoglykemi. Fordi Glyset gitt i kombinasjon med sulfonylurea eller insulin vil føre til en ytterligere senking av blodsukkeret, kan det øke det hypoglykemiske potensialet til disse midlene. Risikoen for hypoglykemi, dens symptomer og behandling og forhold som disponerer for dens utvikling, bør forstås godt av pasienter og ansvarlige familiemedlemmer. Fordi Glyset forhindrer nedbrytning av bordsukker, bør en kilde til glukose (dekstrose, D-glukose) være lett tilgjengelig for å behandle symptomer på lavt blodsukker når du tar Glyset i kombinasjon med en sulfonylurea eller insulin.
- Hvis bivirkninger oppstår med Glyset, utvikler de seg vanligvis i løpet av de første ukene av behandlingen. De er oftest milde til moderate doserelaterte gastrointestinale effekter, som flatulens, myke avføring, diaré eller ubehag i magen, og de avtar generelt i frekvens og intensitet med tid. Seponering av medikament resulterer vanligvis i rask oppløsning av disse gastrointestinale symptomene.
Laboratorietester
Terapeutisk respons på GLYSET kan overvåkes ved periodiske blodsukkertester. Måling av glykosylert hemoglobinnivå anbefales for overvåking av langsiktig glykemisk kontroll.
Hos 12 friske menn påvirket ikke antacida samtidig administrert antacid farmakokinetikken til miglitol.
Narkotikahandel
Flere studier undersøkte mulig interaksjon mellom miglitol og glyburid. Hos seks friske frivillige som fikk en enkelt dose 5 mg glyburid på bakgrunn av 6 dagers behandling med miglitol (50 mg 3 ganger daglig i 4 dager etterfulgt av 100 mg 3 ganger daglig i 2 dager) eller placebo, gjennomsnittet Cmax og AUC-verdiene for glyburid var henholdsvis 17% og 25% lavere når glyburid ble gitt med miglitol. I en studie med diabetespasienter der effekten av å tilsette miglitol 100 mg 3 ganger daglig i 7 dager eller placebo til et bakgrunnsregime på 3,5 mg glyburid daglig ble undersøkt, den gjennomsnittlige AUC-verdien for glyburid var 18% lavere i gruppen behandlet med miglitol, selv om denne forskjellen ikke var statistisk betydelige. Ytterligere informasjon om en potensiell interaksjon med glyburid ble oppnådd fra en av de store amerikanske kliniske studier (Studie 7) der pasienter fikk dos med enten miglitol eller placebo på en bakgrunn av 10 mg glyburid to ganger daglig. Ved 6-måneders og 1-årige klinikkbesøk viste pasienter som tok samtidig miglitol 100 mg 3 ganger daglig, gjennomsnittlig Cmax verdiene for glyburid som var henholdsvis 16% og 8% lavere, sammenlignet med pasienter som tok glyburid alene. Disse forskjellene var imidlertid ikke statistisk signifikante. Selv om det var en trend mot lavere AUC og Cmax verdier for glyburid når det gis sammen med Glyset, kan ingen definitive uttalelser angående en potensiell interaksjon gjøres basert på de foregående tre studiene.
Effekten av miglitol (100 mg 3 ganger daglig i 7 dager) på farmakokinetikken til en enkelt 1000 mg dose metformin ble undersøkt hos friske frivillige. Gjennomsnittlig AUC og Cmax verdiene for metformin var 12 til 13% lavere når de frivillige fikk miglitol sammenlignet med placebo, men denne forskjellen var ikke statistisk signifikant.
I en sunn frivillighetsstudie, samtidig administrering av 50 mg eller 100 mg miglitol 3 ganger daglig sammen med digoksin reduserte de gjennomsnittlige plasmakonsentrasjonene av digoksin med 19% og 28%, henholdsvis. Hos diabetespasienter under behandling med digoksin ble plasmakonsentrasjon av digoksin imidlertid ikke endret ved samtidig administrering av miglitol 100 mg 3 ganger daglig à 14 dager.
Andre sunne frivillige studier har vist at miglitol kan redusere biotilgjengeligheten til ranitidin og propranolol betydelig med henholdsvis 60% og 40%. Ingen effekt av miglitol ble observert på farmakokinetikken eller farmakodynamikken til verken warfarin eller nifedipin.
Adestinal adsorbenter (f.eks. Trekull) og fordøyelsesenzymet preparater som inneholder karbohydratdelende enzymer (f.eks. amylase, pankreatin) kan redusere effekten av Glyset og bør ikke tas samtidig.
Hos 12 friske menn påvirket ikke antacida samtidig administrert antacid farmakokinetikken til miglitol.
Karsinogenese, mutagenese og svekkelse av fruktbarhet
Miglitol ble gitt til mus i kostholdet i doser så høye som ca. 500 mg / kg kroppsvekt (tilsvarer mer enn 5 ganger eksponeringen hos mennesker basert på AUC) i 21 måneder. I en to-årig rottestudie ble miglitol administrert i kostholdet ved eksponeringer som var sammenlignbare med maksimal eksponering for mennesker basert på AUC. Det var ingen bevis for kreftfremkallende effekter som følge av diettbehandling med miglitol.
In vitro ble det funnet at miglitol var ikke-mutagent ved bakteriemutageneseanalysen (Ames) og den eukaryote fremad mutasjonsanalyse (CHO / HGPRT). Miglitol hadde ingen klastogene effekter in vivo i mikronukleustesten av musen. Det ble ikke påvist arvelige mutasjoner ved dominerende dødelig analyse.
En kombinert mannlig og kvinnelig fruktbarhetsstudie utført på Wistar-rotter behandlet oralt med miglitol i dosenivåer på 300 mg / kg kroppsvekt (omtrent 8 ganger den maksimale menneskelige eksponeringen basert på kroppsoverflaten) ga ingen ulempe på reproduktiv ytelse eller evne å reprodusere. I tillegg ble ikke overlevelsen, veksten, utviklingen og fruktbarheten til avkommet kompromittert.
Svangerskap
Teratogene effekter
Graviditet kategori B
Sikkerheten til GLYSET hos gravide er ikke fastslått. Utviklings toksikologistudier er utført på rotter i doser på 50, 150 og 450 mg / kg, tilsvarende til nivåer på omtrent 1,5, 4 og 12 ganger maksimal anbefalt eksponering for mennesker basert på kroppsoverflaten område. Hos kaniner ble doser på 10, 45 og 200 mg / kg tilsvarende nivåer på omtrent 0,5, 3 og 10 ganger den menneskelige eksponeringen undersøkt. Disse studiene avdekket ingen bevis for misdannelser i fosteret som kan tilskrives miglitol. Doser av miglitol opptil 4 og 3 ganger den menneskelige dosen (basert på kroppsoverflaten) for henholdsvis rotter og kaniner, avslørte ikke bevis for nedsatt fruktbarhet eller skade på fosteret. De høyeste dosene som ble testet i disse studiene, 450 mg / kg hos rotta og 200 mg / kg hos kanin fremmet mors og / eller fostertoksisitet. Fetotoksisitet ble indikert av en svak, men betydelig reduksjon i fosterets vekt i rotteundersøkelsen og svak reduksjon i fostervekt, forsinket ossifisering av fosterets skjelett og økning i prosentandelen av ikke-levedyktige fostre hos kaninen studere. I peri-postnatal studie på rotter var NOAEL (No Observed Adverse Effect Level) 100 mg / kg (tilsvarende omtrent fire ganger eksponeringen for mennesker, basert på kroppsoverflateareal). En økning i dødfødt avkom ble observert ved den høye dosen (300 mg / kg) i rotta per-postnatal studie, men ikke ved den høye dosen (450 mg / kg) i leveringssegmentet for rotteutviklingstoksisitet studere. Ellers var det ingen bivirkninger på overlevelse, vekst, utvikling, atferd eller fruktbarhet i verken rotteutviklingstoksisitet eller peri-postnatal studier. Det er imidlertid ingen tilstrekkelige og godt kontrollerte studier på gravide. Fordi dyreproduksjonsstudier ikke alltid er forutsi menneskelig respons, bør dette stoffet bare brukes under graviditet hvis det er klart nødvendig.
Sykepleiermødre
Det er vist at Miglitol skilles ut i morsmelk i veldig liten grad. Total utskillelse i melk utgjorde 0,02% av en 100 mg morsdose. Beregnet eksponering for et ammende barn er omtrent 0,4% av mors dose. Selv om nivåene av miglitol oppnådd i morsmelk er svært lave, anbefales det at GLYSET ikke administreres til en ammende kvinne.
Pediatrisk bruk
Sikkerhet og effektivitet av GLYSET hos barn er ikke fastslått.
Geriatrisk bruk
Av det totale antall forsøkspersoner i kliniske studier av GLYSET i USA, inkluderte pasienter gyldige for sikkerhetsanalyser 24% over 65 og 3% over 75. Ingen generelle forskjeller i sikkerhet og effektivitet ble observert mellom disse forsøkspersonene og yngre. Farmakokinetikken til miglitol ble studert hos eldre og unge menn (n = 8 per gruppe). Ved doseringen 100 mg 3 ganger daglig i 3 dager, ble det ikke funnet noen forskjeller mellom de to gruppene.
topp
Bivirkninger
gastrointestinal
Gastrointestinale symptomer er de vanligste reaksjonene på GLYSET tabletter. I amerikanske placebokontrollerte studier var forekomsten av magesmerter, diaré og flatulens henholdsvis 11,7%, 28,7% og 41,5% i 962 pasienter behandlet med GLYSET 25-100 mg 3 ganger daglig, mens de tilsvarende forekomstene var 4,7%, 10,0% og 12,0% hos 603 placebo-behandlet pasienter. Forekomsten av diaré og magesmerter hadde en tendens til å avta betydelig ved fortsatt behandling.
Dermatologic
Det ble rapportert hudutslett hos 4,3% av pasientene som ble behandlet med GLYSET sammenlignet med 2,4% av placebo-behandlede pasienter. Utslett var generelt forbigående og de fleste ble vurdert som ikke relatert til GLYSET av lege-etterforskere.
Unormale laboratoriefunn
Jern med lavt serum forekom oftere hos pasienter behandlet med GLYSET (9,2%) enn hos placebo-behandlede pasienter (4,2%), men gjorde ikke vedvarer i de fleste tilfeller og var ikke assosiert med reduksjon i hemoglobin eller endringer i andre hematologiske indekser.
topp
Overdosering dosering~~POS=HEADCOMP
I motsetning til sulfonylurea eller insulin, vil en overdose av GLYSET tabletter ikke føre til hypoglykemi. En overdose kan føre til forbigående økning i flatulens, diaré og ubehag i magen. På grunn av mangelen på ekstra-tarmeffekter sett med GLYSET, forventes ingen alvorlige systemiske reaksjoner i tilfelle en overdose.
topp
Dosering og administrasjon
Det er ingen faste doseringsregimer for behandling av diabetes mellitus med GLYSET tabletter eller andre farmakologiske midler. Dosering av GLYSET må individualiseres på grunnlag av både effektivitet og toleranse mens den ikke overstiger den anbefalte maksimale dosen på 100 mg 3 ganger daglig. GLYSET bør tas tre ganger daglig ved starten (med første bit) av hvert hovedmåltid. GLYSET bør startes med 25 mg, og dosen økes gradvis som beskrevet nedenfor, begge for å redusere gastrointestinale bivirkninger og for å tillate identifikasjon av minimumsdosen som kreves for adekvat glykemisk kontroll av pasienten.
Under behandlingsstart og dosetitrering (se nedenfor) kan det være en times postprandial plasmaglukose brukes til å bestemme den terapeutiske responsen på GLYSET og identifisere den minimale effektive dosen for tålmodig. Deretter skal glykosylert hemoglobin måles med intervaller på omtrent tre måneder. Det terapeutiske målet bør være å redusere både postprandial plasmaglukose og glykosylert hemoglobinnivå til normalt eller nær normalt ved å bruke den laveste effektive dosen av GLYSET, enten som monoterapi eller i kombinasjon med en sulfonylurea.
Opprinnelig dosering
Den anbefalte startdosen av GLYSET er 25 mg, gitt oralt tre ganger daglig ved starten (med første bit) av hvert hovedmåltid. Noen pasienter kan imidlertid ha fordel ved å starte med 25 mg en gang daglig for å minimere bivirkninger i mage-tarmkanalen, og gradvis øke hyppigheten av administrasjonen til 3 ganger daglig.
Vedlikeholdsdosering
Den vanlige vedlikeholdsdosen av GLYSET er 50 mg 3 ganger daglig, selv om noen pasienter kan ha fordel av å øke dosen til 100 mg 3 ganger daglig. For å tillate tilpasning til potensielle bivirkninger i mage-tarmkanalen, anbefales det at GLYSET-terapi skjer initiert i en dosering på 25 mg 3 ganger daglig, den laveste effektive dosen, og deretter gradvis titrert oppover for å tillate tilpasning. Etter 4 - 8 uker med 25 mg 3 ganger daglig behandling, bør dosen økes til 50 mg 3 ganger daglig cirka tre måneder, hvoretter et glykosylert hemoglobinnivå skal måles for å vurdere terapeutisk respons. Hvis det glykosylerte hemoglobinnivået på det tidspunktet ikke er tilfredsstillende, kan dosen økes ytterligere til 100 mg 3 ganger daglig, den maksimale anbefalte dosen. Samlede data fra kontrollerte studier antyder en doserespons for både HbA1c og en times postprandial plasmaglukose i det anbefalte doseringsområdet. Imidlertid har ingen enkelt studie undersøkt effekten på glykemisk kontroll av dosering av pasientens doser oppover i samme studie. Hvis ingen ytterligere reduksjon i postprandial glukose eller glykosylert hemoglobinnivå blir observert med titrering til 100 mg 3 ganger daglig, bør det vurderes å senke dosen. Når en effektiv og tolerert dosering er etablert, bør den opprettholdes.
Maksimal dosering
Maksimal anbefalt dosering av GLYSET er 100 mg 3 ganger daglig. I en klinisk studie ga 200 mg 3 ganger daglig ytterligere forbedret glykemisk kontroll, men økte forekomsten av gastrointestinale symptomer beskrevet ovenfor.
Pasienter som mottar sulfonylurea
Sulfonylurea-midler kan forårsake hypoglykemi. Det var ingen økt forekomst av hypoglykemi hos pasienter som tok GLYSET i kombinasjon med sulfonylurea midler sammenlignet med forekomsten av hypoglykemi hos pasienter som fikk sulfonylurea alene i en hvilken som helst klinisk rettssaken.
Imidlertid vil GLYSET gitt i kombinasjon med sulfonylurea føre til en ytterligere senking av blodsukkeret og kan øke risikoen for hypoglykemi på grunn av additive effekter av de to midlene. Hvis hypoglykemi oppstår, bør passende justeringer av doseringen av disse midlene gjøres.
topp
Hvordan leveres
GLYSET tabletter er tilgjengelige som 25 mg, 50 mg og 100 mg hvite, runde, filmdrasjerte tabletter. Tablettene er preget med ordet "GLYSET" på den ene siden og styrken på den andre siden, som indikert nedenfor.
| Styrke | NDC | Nettbrettidentifikasjon | |
| Front | Tilbake | ||
| Flasker på 100: | |||
| 25 mg | 0009-5012-01 | GLYSET | 25 |
| 50 mg | 0009-5013-01 | GLYSET | 50 |
| 100 mg | 0009-5014-01 | GLYSET | 100 |
Oppbevares ved 25 ° C; utflukter tillatt til 15-30 ° C (59 ° -86 ° F) [se USP kontrollert romtemperatur].
Bare Rx

Laget av:
Bayer HealthCare AG
Leverkusen, Tyskland
Glyset er et registrert varemerke for Bayer HealthCare Pharmaceuticals Inc brukt under lisens.
LAB-0167 til 6,0
sist oppdatert 05/2008
Glyset, miglitol, pasientinformasjon (på vanlig engelsk)
Detaljert informasjon om tegn, symptomer, årsaker, behandling av diabetes
Informasjonen i denne monografien er ikke ment å dekke all mulig bruk, instruksjoner, forsiktighetsregler, medikamentinteraksjoner eller uheldige effekter. Denne informasjonen er generalisert og er ikke ment som spesifikk medisinsk råd. Hvis du har spørsmål om medisinene du tar eller ønsker mer informasjon, bør du kontakte lege, apotek eller sykepleier.
tilbake til: Bla gjennom alle medisiner for diabetes



