Iloperidone (fanapt) Full forskrivningsinformasjon
Merkenavn: Fanapt
Generisk navn: Iloperidone
Fanapt (Iloperidone) forskrivningsveiledning (PDF)
Innhold:
Boxed Warning
Indikasjoner og bruk
Dosering og administrasjon
Kontra
Advarsler og forsiktighetsregler
Bivirkninger
Narkotikahandel
Bruk i spesifikke befolkninger
Narkotikamisbruk og avhengighet
Overdose
Beskrivelse
Klinisk farmakologi
Ikke-klinisk toksikologi
Kliniske studier
Hvordan leveres
Brintellix medisineringsveiledning
ADVARSEL: Økt MORTALITET I ELDRE PASIENTER MED DEMENTIA-RELATERT PSYKOSE
Eldre pasienter med demensrelatert psykose behandlet med antipsykotiske medisiner har økt risiko for død. FANAPT er ikke godkjent for behandling av pasienter med demensrelatert psykose.
Indikasjoner og bruk
FANAPT® er indisert for behandling av schizofreni hos voksne.
Når han bestemmer seg for de alternative behandlingene som er tilgjengelige for denne tilstanden, bør forskriveren vurdere funnet at FANAPT er assosiert med forlengelse av QTc-intervallet. Forlengelse av QTc-intervallet er assosiert i noen andre medisiner med evnen til å forårsake torsade de arytmi av pointes-type, en potensielt dødelig polymorf ventrikkeltakykardi som kan føre til plutselig død. I mange tilfeller vil dette føre til konklusjonen at andre medikamenter bør prøves først. Hvorvidt FANAPT vil forårsake torsade de pointes eller øke frekvensen av plutselig død, er ennå ikke kjent.
Pasienter må titreres til en effektiv dose FANAPT. Dermed kan kontroll av symptomer bli forsinket i løpet av de første 1 til 2 ukene av behandlingen sammenlignet med noen andre antipsykotiske medisiner som ikke krever en lignende titrering. Forskrivere bør være oppmerksom på denne forsinkelsen når de velger et antipsykotisk legemiddel for behandling av schizofreni.
fortsett historien nedenfor
Dosering og administrasjon
Vanlig dose
FANAPT må titreres sakte fra en lav startdose for å unngå ortostatisk hypotensjon på grunn av dets alfa-adrenerge blokkeringsegenskaper. Den anbefalte startdosen for FANAPT tabletter er 1 mg oralt to ganger daglig. Dosen øker for å nå målområdet 6 -12 mg to ganger daglig (12_24 mg / dag) kan gjøres med daglige dosejusteringer for ikke å overstige 2 mg to ganger daglig (4 mg / dag). Maksimal anbefalt dose er 12 mg to ganger daglig (24 mg / dag). FANAPT doser over 24 mg / dag er ikke blitt systematisk evaluert i de kliniske studiene. Effektivitet ble påvist med FANAPT i et doseområde fra 6 til 12 mg to ganger daglig. Forskrivere må være oppmerksom på at pasienter må titreres til en effektiv dose FANAPT. Dermed kan kontroll av symptomer bli forsinket i løpet av de første 1 til 2 ukene av behandlingen sammenlignet med noen andre antipsykotiske medisiner som ikke krever lignende titrering. Foreskrivere bør også være klar over at noen bivirkninger forbundet med FANAPT-bruk er doserelatert. FANAPT kan administreres uten hensyn til måltider.
Dosering i spesielle befolkninger
Dosjustering for pasienter som tar FANAPT samtidig med potensielle CYP2D6-hemmere: FANAPT-dose bør være redusert med halvparten når det gis samtidig med sterke CYP2D6-hemmere som fluoksetin eller paroksetin. Når CYP2D6-hemmeren trekkes ut av kombinasjonsbehandlingen, bør FANAPT-dosen økes til den var før.
Dosjustering for pasienter som tar FANAPT samtidig med potensielle CYP3A4-hemmere: FANAPT-dose bør være redusert med halvparten når det gis samtidig med sterke CYP3A4-hemmere som ketoconazol eller klaritromycin. Når CYP3A4-hemmeren trekkes ut av kombinasjonsbehandlingen, bør FANAPT-dosen økes til der den var før.
Dosjustering for pasienter som tar FANAPT som er dårlige metabolisatorer av CYP2D6: FANAPT-dose bør reduseres med halvparten for dårlig metabolisator av CYP2D6.
Nedsatt leverfunksjon: Ingen dosejustering av FANAPT er nødvendig hos pasienter med lett nedsatt leverfunksjon. Pasienter med moderat nedsatt leverfunksjon kan kreve dosereduksjon, hvis klinisk indikert. FANAPT anbefales ikke til pasienter med alvorlig nedsatt leverfunksjon.
Vedlikeholdsbehandling
I en lengre tids studie var FANAPT effektiv til å utsette tid til tilbakefall hos pasienter med schizofreni som ble stabilisert på FANAPT opptil 24 mg / dag. Pasienter bør revurderes med jevne mellomrom for å bestemme behovet for vedlikeholdsbehandling.
Reinitiering av behandlingen hos pasienter som tidligere ble avsluttet Selv om det ikke foreligger data for spesifikt å adressere reinitiering av behandling, anbefales det at initieringstitreringsplanen følges når pasienter har hatt et intervall utenfor FANAPT på mer enn 3 dager.
topp
Doseringsformer og styrker
FANAPT tabletter er tilgjengelige i følgende styrker: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg og 12 mg. Tablettene er hvite, runde, flate, skråkantede og identifisert med en logo "" preget på den ene siden og tablettstyrken "1", "2", "4", "6", "8", "10", eller “12” preget på den andre siden.
topp
Kontra
FANAPT er kontraindisert hos personer med en kjent overfølsomhetsreaksjon på produktet. Anafylaksi, angioødem og andre overfølsomhetsreaksjoner er rapportert.
topp
ADVARSLER OG FORHOLDSREGLER
Økt dødelighet hos eldre pasienter med demensrelatert psykose
Antipsykotiske medikamenter øker dødsrisikoen til alle årsaker hos eldre pasienter med demensrelatert psykose. Analyser av 17 demensrelaterte placebokontrollerte psykoseforsøk (modal varighet på 10 uker og i stor grad hos pasienter som tar atypiske antipsykotiske medikamenter) avdekket en risiko for død hos de medikamentbehandlede pasientene på mellom 1,6 til 1,7 ganger i forhold til placebo-behandlede pasienter. I løpet av en typisk 10-ukers kontrollert studie var dødsraten hos legemiddelbehandlede pasienter omtrent 4,5%, sammenlignet med en rate på omtrent 2,6% hos placebo-behandlede pasienter.
Selv om dødsårsakene var forskjellige, så de fleste av dødsfallene ut til å være enten kardiovaskulær (f.eks. Hjertesvikt, plutselig død) eller smittsom (f.eks. Lungebetennelse) i naturen. FANAPT er ikke godkjent for behandling av pasienter med demensrelatert psykose.
Cerebrovaskulære bivirkninger, inkludert hjerneslag, hos eldre pasienter med demensrelatert psykose
I placebokontrollerte studier hos eldre personer med demens, randomiserte pasienter til risperidon, aripiprazol, og olanzapin hadde høyere forekomst av hjerneslag og forbigående iskemisk angrep, inkludert dødelig hjerneslag. FANAPT er ikke godkjent for behandling av pasienter med demensrelatert psykose.
QT-forlengelse
I en åpen merket QTc-studie hos pasienter med schizofreni eller schizoaffektiv lidelse (n = 160), ble FANAPT assosiert med QTc-forlengelse på 9 msek ved en iloperidondose på 12 mg to ganger daglig. Effekten av FANAPT på QT-intervallet ble forsterket av tilstedeværelsen av CYP450 2D6 eller 3A4 metabolsk hemming (henholdsvis paroksetin 20 mg en gang daglig og ketoconazol 200 mg to ganger daglig). Under betingelser med metabolsk hemming for både 2D6 og 3A4, var FANAPT 12 mg to ganger daglig assosiert med en gjennomsnittlig QTcF-økning fra baseline på omtrent 19 msek.
Ingen tilfeller av torsade de pointes eller andre alvorlige hjertearytmier ble observert under det kliniske programmet før markedsføring.
Bruk av FANAPT bør unngås i kombinasjon med andre medisiner som er kjent for å forlenge QTc inkludert klasse 1A (f.eks. Kinidin, procainamid) eller klasse III (f.eks. amiodaron, sotalol) antiarytmiske medisiner, antipsykotiske medisiner (f.eks. klorpromazin, tioridazin), antibiotika (f.eks. gatifloxacin, moxifloxacin) eller hvilken som helst annen klasse medisiner som er kjent for å forlenge QTc-intervallet (f.eks. pentamidin, levometadylacetat, metadon). FANAPT bør også unngås hos pasienter med medfødt langt QT-syndrom og hos pasienter med en historie med hjertearytmier.
Enkelte omstendigheter kan øke risikoen for torsade de pointes og / eller plutselig død i forbindelse med bruk av medisiner som forlenger QTc-intervallet, inkludert (1) bradykardi; (2) hypokalemia eller hypomagnesemia; (3) samtidig bruk av andre medisiner som forlenger QTc-intervallet; og (4) tilstedeværelse av medfødt forlengelse av QT-intervallet; (5) nylig akutt hjerteinfarkt; og / eller (6) ukompensert hjertesvikt.
Forsiktighet er garantert når FANAPT forskrives med legemidler som hemmer FANAPT-metabolisme, og hos pasienter med redusert aktivitet av CYP2D6.
Det anbefales at pasienter som vurderes for FANAPT-behandling som er utsatt for betydelig risiko elektrolyttforstyrrelser har målinger av kalium og magnesium i serien med periodiske overvåkning. Hypokalemi (og / eller hypomagnesemia) kan øke risikoen for forlengelse av QT og arytmi. FANAPT bør unngås hos pasienter med historie med betydelig hjerte- og karsykdom, for eksempel QT forlengelse, nylig akutt hjerteinfarkt, ukompensert hjertesvikt eller hjertearytmi. FANAPT bør seponeres hos pasienter som viser seg å ha vedvarende QTc-målinger> 500 msek.
Hvis pasienter som tar FANAPT opplever symptomer som kan indikere forekomst av hjertearytmier, f.eks. svimmelhet, hjertebank eller synkope, bør forskrivningen sette i gang ytterligere evaluering, inkludert hjerte overvåkning.
Malignt nevroleptisk syndrom (NMS)
Et potensielt dødelig symptomkompleks som noen ganger er referert til som nevreptisk malignt syndrom (NMS), er rapportert i forbindelse med administrering av antipsykotiske medisiner, inkludert FANAPT. Kliniske manifestasjoner inkluderer hyperpyrexia, muskelstivhet, endret mental status (inkludert katatoniske tegn) og bevis på autonom ustabilitet (uregelmessig puls eller blodtrykk, takykardi, diaphorese og hjerte dysrytmi). Ytterligere tegn kan være forhøyet kreatinfosfokinase, myoglobinuri (rabdomyolyse) og akutt nyresvikt. Den diagnostiske evalueringen av pasienter med dette syndromet er komplisert. Når du kommer frem til en diagnose, er det viktig å identifisere tilfeller der den kliniske presentasjonen inkluderer både alvorlig medisinsk sykdom og ubehandlede eller utilstrekkelig behandlede ekstrapyramidale tegn og symptomer (EPS). Andre viktige hensyn ved differensialdiagnosen inkluderer sentral antikolinerg toksisitet, heteslag, medikamentfeber og primær sentralnervesystem (CNS) patologi.
Håndteringen av dette syndromet bør omfatte: (1) øyeblikkelig seponering av antipsykotiske medisiner og andre medisiner som ikke er avgjørende for samtidig behandling, (2) intensiv symptomatisk behandling og medisinsk overvåking, og (3) behandling av eventuelle samtidig alvorlige medisinske problemer som spesifikke behandlinger er tilgjengelige for. Det er ingen generell enighet om spesifikke farmakologiske behandlingsregimer for NMS.
Hvis en pasient trenger antipsykotisk medikamentell behandling etter utvinning fra NMS, bør den potensielle gjeninnføringen av medikamentell behandling vurderes nøye. Pasienten bør overvåkes nøye, siden det er rapportert om tilbakefall av NMS.
Tardive Dyskinesia
Tardiv dyskinesi er et syndrom som består av potensielt irreversible, ufrivillige, dyskinetiske bevegelser, som kan utvikle seg hos pasienter behandlet med antipsykotiske medisiner. Selv om utbredelsen av syndromet ser ut til å være høyest blant eldre, spesielt eldre kvinner, er det umulig å gjøre det stole på prevalensestimater for å forutsi, ved begynnelsen av antipsykotisk behandling, hvilke pasienter som sannsynligvis vil utvikle syndrom. Hvorvidt antipsykotiske medikamenter varierer i potensialet deres til å forårsake tardiv dyskinesi, er ukjent.
Risikoen for å utvikle tardiv dyskinesi og sannsynligheten for at den vil bli irreversibel, antas å øke etter behandlingsvarigheten og den totale kumulative dosen av antipsykotisk administrert øker. Syndromet kan imidlertid utvikle seg, selv om det er mye mindre vanlig, etter relativt korte behandlingsperioder i lave doser.
Det er ingen kjent behandling for etablerte tilfeller av tardiv dyskinesi, selv om syndromet kan gå tilbake, delvis eller fullstendig, hvis antipsykotisk behandling trekkes tilbake. Antipsykotisk behandling i seg selv kan imidlertid undertrykke (eller delvis undertrykke) tegnene og symptomene på syndromet og derved muligens maskere den underliggende prosessen. Effekten som symptomatisk undertrykkelse har på det langsiktige forløpet av syndromet er ukjent.
Gitt disse hensynene, bør FANAPT foreskrives på en måte som mest sannsynlig vil minimere forekomsten av tardiv dyskinesi. Kronisk antipsykotisk behandling bør generelt reserveres for pasienter som lider av en kronisk sykdom som (1) er kjent for å svare på antipsykotiske medikamenter, og (2) for hvilke alternative, like effektive, men potensielt mindre skadelige behandlinger ikke er tilgjengelige eller passende. Hos pasienter som trenger kronisk behandling, bør man søke den minste dosen og den korteste behandlingsvarigheten som gir en tilfredsstillende klinisk respons. Behovet for fortsatt behandling bør revurderes med jevne mellomrom.
Hvis det oppstår tegn og symptomer på tardiv dyskinesi hos en pasient på FANAPT, bør seponering av medikament vurderes. Noen pasienter kan imidlertid kreve behandling med FANAPT til tross for tilstedeværelsen av syndromet.
Metabolske endringer
Atypiske antipsykotiske medikamenter har blitt assosiert med metabolske forandringer som kan øke kardiovaskulær / cerebrovaskulær risiko. Disse metabolske endringene inkluderer hyperglykemi, dyslipidemi og vektøkning i kroppen. Mens alle atypiske antipsykotiske medisiner har vist seg å produsere noen metabolske forandringer, har hvert medikament i klassen sin egen spesifikke risikoprofil.
Hyperglykemi og diabetes mellitus
Hyperglykemi, i noen tilfeller ekstrem og assosiert med ketoacidose eller hyperosmolar koma eller død, er rapportert hos pasienter som er behandlet med atypiske antipsykotika inkludert FANAPT. Vurdering av forholdet mellom atypisk antipsykotisk bruk og glukoseavvik kompliseres av muligheten for økt bakgrunnsrisiko for diabetes mellitus hos pasienter med schizofreni og den økende forekomsten av diabetes mellitus generelt befolkning. Gitt disse konfundererne, er ikke forholdet mellom atypisk antipsykotisk bruk og hyperglykemirelaterte bivirkninger forstått helt. Epidemiologiske studier antyder imidlertid økt risiko for hyperglykemirelaterte bivirkninger hos pasienter behandlet med atypiske antipsykotika inkludert i disse studiene.
Pasienter med en etablert diagnose av diabetes mellitus som startes på atypiske antipsykotika, bør overvåkes regelmessig for å forverre glukosekontrollen. Pasienter med risikofaktorer for diabetes mellitus (f.eks. Overvekt, familiehistorie av diabetes) som begynner behandlingen med atypiske antipsykotika skal gjennomgå faste blodsukkertesting i begynnelsen av behandlingen og med jevne mellomrom behandling. Alle pasienter som behandles med atypiske antipsykotika, bør overvåkes for symptomer på hyperglykemi inkludert polydipsi, poluri, polyfagi og svakhet. Pasienter som utvikler symptomer på hyperglykemi under behandling med atypiske antipsykotika, må gjennomgå faste blodsukkertesting. I noen tilfeller har hyperglykemi løst seg når den atypiske antipsykotika ble avbrutt; Noen pasienter trengte imidlertid fortsettelse av antidiabetisk behandling til tross for seponering av det mistenkte legemidlet.
Data fra en 4 - ukers fastdosestudie hos voksne personer med schizofreni, hvor faste blodprøver ble tatt, er presentert i tabell 1.
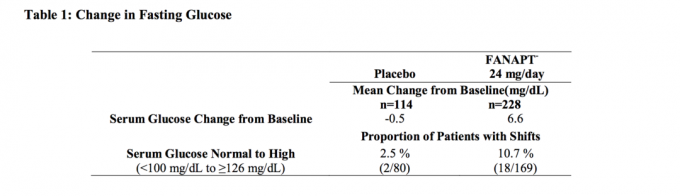
Samlede analyser av glukosedata fra kliniske studier inkludert langsiktige studier er vist i tabell2.

dyslipidemi
Uønskede forandringer i lipider er observert hos pasienter behandlet med atypiske antipsykotika.
Data fra en placebokontrollert, 4-ukers fastdosestudie, hvor faste blodprøver ble trukket, hos voksne personer med schizofreni er presentert i tabell 3.

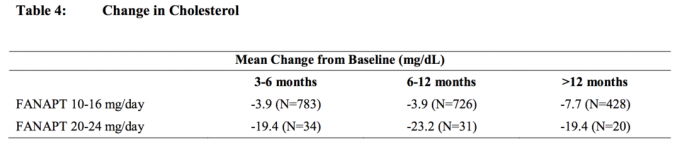
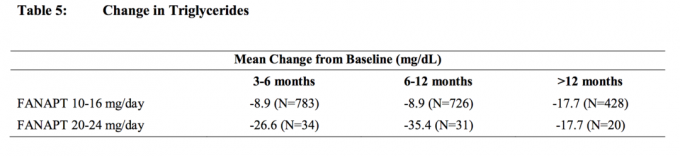
Samlede analyser av kolesterol- og triglyseriddata fra kliniske studier inkludert langsiktige studier er vist i tabell 4 og tabell 5.
Vektøkning
Det er observert vektøkning ved atypisk antipsykotisk bruk. Klinisk overvåking av vekt anbefales.
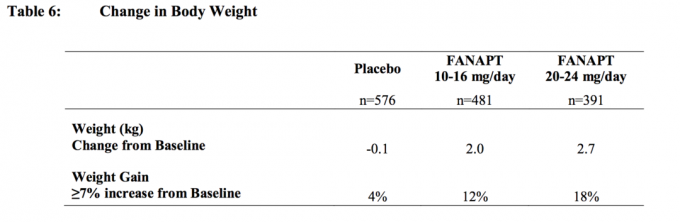
I alle kort- og langtidsstudier var den totale gjennomsnittlige endringen fra baseline ved endepunktet 2,1 kg.
Endringer i kroppsvekt (kg) og andelen av personer med ≥7% økning i kroppsvekt fra 4 placebokontrollerte, 4- eller 6-ukers, faste eller fleksible doserundersøkelser hos voksne er presentert i Tabell 6.
beslag
I kortvarige placebokontrollerte studier (4- til 6-uker) forekom anfall hos 0,1% (1/1344) av pasientene som ble behandlet med FANAPT sammenlignet med 0,3% (2/587) på placebo. Som med andre antipsykotika, bør FANAPT brukes forsiktig hos pasienter med anfall av anfall eller med tilstander som potensielt senker anfallsterskelen. Forhold som senker anfallsterskelen kan være mer utbredt i en befolkning på 65 år eller eldre.
Ortostatisk hypotensjon og synkope
FANAPT kan indusere ortostatisk hypotensjon assosiert med svimmelhet, takykardi og synkope. Dette gjenspeiler dens alfa-adrenerge antagonistegenskaper. I dobbeltblinde placebokontrollerte kortvarige studier, hvor dosen ble økt sakte, som anbefalt ovenfor ble synkope rapportert hos 0,4% (5/1344) av pasienter behandlet med FANAPT, sammenlignet med 0,2% (1/587) på placebo. Ortostatisk hypotensjon ble rapportert hos 5% av pasientene som fikk 20-24 mg / dag, 3% av pasientene gitt 10-16 mg / dag og 1% av pasientene fikk placebo. En raskere titrering forventes å øke frekvensen av ortostatisk hypotensjon og synkope.
FANAPT bør brukes med forsiktighet hos pasienter med kjent hjerte- og karsykdom (f.eks. Hjertesvikt, historie med hjerteinfarkt, iskemi eller ledning abnormaliteter), cerebrovaskulær sykdom eller tilstander som disponerer pasienten for hypotensjon (dehydrering, hypovolemia og behandling med antihypertensiv medikamenter). Overvåking av ortostatiske vitale tegn bør vurderes hos pasienter som er sårbare for hypotensjon.
Leukopenia, Neutropenia og Agranulocytosis
I kliniske studier og etter markedsføring er det rapportert om tilfeller av leukopeni / nøytropeni midlertidig relatert til antipsykotiske midler. Agranulocytosis (inkludert dødelige tilfeller) er også rapportert.
Mulige risikofaktorer for leukopeni / nøytropeni inkluderer forhåndsbestående lavt antall hvite blodlegemer (WBC) og historie med medikamentindusert leukopeni / neutropeni. Pasienter med en eksisterende lav WBC eller en historie med medikamentindusert leukopeni / nøytropeni, bør få fullstendig blodtelling (CBC) overvåket ofte i løpet av de første månedene av behandlingen og bør avbryte FANAPT ved det første tegnet på en nedgang i WBC i fravær av annen årsakssammenheng faktorer.
Pasienter med nøytropeni bør overvåkes nøye for feber eller andre symptomer eller tegn på infeksjon og behandles omgående hvis slike symptomer eller tegn oppstår. Pasienter med alvorlig nøytropeni (absolutt nøytrofiltall <1000 / mm3) bør avbryte FANAPT og få sin WBC fulgt til bedring.
hyperprolaktinemi
Som med andre medisiner som motvirker dopamin D2-reseptorer, hever FANAPT prolaktinnivået.
Hyperprolaktinemi kan undertrykke hypothalamisk GnRH, noe som kan føre til redusert gonadotropinsekresjon av hypofysen. Dette kan igjen hemme reproduksjonsfunksjonen ved å svekke gonadalsteroidogenese hos både kvinnelige og mannlige pasienter. Galaktoré, amenoré, gynekomasti og impotens er rapportert med prolaktin-forhøyende forbindelser. Langvarig hyperprolaktinemi når det er assosiert med hypogonadisme kan føre til redusert bentetthet hos både kvinnelige og mannlige pasienter.
Vevskultureksperimenter indikerer at omtrent en tredjedel av menneskelige brystkreft er prolaktinavhengig in vitro, en faktor av potensiell betydning hvis reseptbelagte medisiner er tenkt på en pasient med tidligere påvist bryst kreft. Proliferative forandringer i brystkjertelen og økningen i serumprolaktin ble sett hos mus og rotter behandlet med FANAPT. Verken kliniske studier eller epidemiologiske studier utført til dags dato har vist en sammenheng mellom kronisk administrering av denne klassen av medikamenter og tumorigenese hos mennesker; det tilgjengelige beviset anses for begrenset til å være avgjørende på dette tidspunktet.
I en kortvarig placebokontrollert studie (4-uker), var den gjennomsnittlige endringen fra basislinje til sluttpunkt i plasma-prolaktinnivåer for FANAPT 24 mg / dag-behandlet gruppe var en økning på 2,6 ng / ml sammenlignet med en nedgang på 6,3 ng / ml i placebogruppen. I denne studien ble forhøyede plasmaprolaktinnivåer observert hos 26% av voksne behandlet med FANAPT sammenlignet med 12% i placebogruppen. I kortvarige studier var FANAPT assosiert med beskjedne nivåer av prolaktinheving sammenlignet med større prolaktinforhøyninger observert med noen andre antipsykotiske midler. I samlet analyse fra kliniske studier inkludert langsiktige studier, ble 3210 voksne behandlet med iloperidon rapportert gynekomasti hos 2 mannlige personer (0,1%) sammenlignet med 0% hos placebo-behandlede pasienter, og galaktoré ble rapportert hos 8 kvinnelige individer (0,2%) sammenlignet med 3 kvinnelige individer (0,5%) hos placebo-behandlede pasienter.
Regulering av kroppstemperatur
Forstyrrelse av kroppens evne til å redusere kroppens kroppstemperatur er blitt tilskrevet antipsykotiske midler. Passende pleie anbefales når du foreskriver FANAPT til pasienter som vil oppleve forhold som kan bidra til en økning i kjernekroppen temperatur, for eksempel å trene anstrengende, eksponering for ekstrem varme, motta samtidig medisinering med antikolinerg aktivitet eller å være utsatt for dehydrering.
dysfagi
Esophageal dysmotilitet og aspirasjon har blitt assosiert med antipsykotisk medisinbruk. Aspirasjons lungebetennelse er en vanlig årsak til sykelighet og dødelighet hos eldre pasienter. FANAPT og andre antipsykotiske medisiner skal brukes forsiktig hos pasienter med risiko for aspirasjons lungebetennelse.
Selvmord
Muligheten for et selvmordsforsøk er iboende i psykotisk sykdom, og nøye tilsyn med høyrisikopasienter bør følge medikamentell terapi. Resepter for FANAPT bør skrives for den minste mengden tabletter i samsvar med god pasientbehandling for å redusere risikoen for overdosering.
priapisme
Tre tilfeller av priapisme ble rapportert i FANAPT-programmet før markedsføring. Legemidler med alfa-adrenerge blokkerende effekter er rapportert å indusere priapisme. FANAPT deler denne farmakologiske aktiviteten. Alvorlig priapisme kan kreve kirurgisk inngrep.
Potensial for kognitiv og motorisk svekkelse
FANAPT har, som andre antipsykotika, potensialet til å svekke dømmekraft, tenking eller motorikk. I kortvarige, placebokontrollerte studier ble søvnighet (inkludert sedasjon) rapportert i 11,9% (104/874) av voksne pasienter behandlet med FANAPT i doser på 10 mg / dag eller høyere versus 5,3% (31/587) behandlet med placebo. Pasienter bør varsles om bruk av farlige maskiner, inkludert biler, til de er rimelig sikre på at behandling med FANAPT ikke påvirker dem negativt.
topp
Bivirkninger
Erfaring med kliniske studier
Fordi kliniske studier utføres under vidt varierende forhold, observeres bivirkningsrater i den kliniske studien av et medikament kan ikke sammenlignes direkte med frekvenser i kliniske studier av et annet legemiddel og reflekterer muligens ikke hastighetene som er observert i kliniske studier øve på. Informasjonen nedenfor er avledet fra en klinisk forsøksdatabase for FANAPT bestående av 3229 pasienter utsatt for FANAPT i doser på 10 mg / dag eller mer, for behandling av schizofreni. Av disse fikk 999 FANAPT i minst 6 måneder, med 657 utsatt for FANAPT i minst 12 måneder. Alle disse pasientene som fikk FANAPT deltok i kliniske studier med flere doser. Betingelsene og varigheten av behandlingen med FANAPT varierte sterkt og inkluderte (i overlappende kategorier), open-label og dobbeltblinde faser av studier, ambulante og polikliniske studier, faste doser og fleksible doser, og kortsiktig og lengre tid eksponering.
Informasjonen presentert i disse seksjonene ble avledet fra samlede data fra 4 placebokontrollerte, 4- eller 6-ukers, studier med fast eller fleksibel dose hos pasienter som fikk FANAPT i daglige doser i området fra 10 til 24 mg (N = 874).
Bivirkninger som forekommer med en forekomst på 2% eller mer blant FANAPT-behandlede pasienter og hyppigere enn placebo
Tabell 7 oppregner de samlede forekomstene av bivirkninger som spontant ble rapportert i fire placebokontrollerte, 4- eller 6-uke, studier med fast eller fleksibel dose, som viser reaksjonene som forekom hos 2% eller mer av pasientene som ble behandlet med FANAPT i en hvilken som helst av dosen. grupper, og som forekomsten hos FANAPT-behandlede pasienter i en hvilken som helst dosegruppe var større enn forekomsten hos pasienter behandlet med placebo.

Doserelaterte bivirkninger i kliniske studier
Basert på de samlede dataene fra 4 placebokontrollerte, 4- eller 6-ukers, faste eller fleksible doser, var bivirkninger som skjedde med mer enn 2% forekomst hos pasientene behandlet med FANAPT, og som forekomsten hos pasienter behandlet med FANAPT 20-24 mg / dag var to ganger enn forekomsten i pasienter behandlet med FANAPT 10-16 mg / dag var: ubehag i magen, svimmelhet, hypotensjon, stivhet i muskel- og skjelettet, takykardi og vekt økt.
Vanlige og medikamentrelaterte bivirkninger i kliniske studier
Basert på de samlede dataene fra 4 placebokontrollerte, 4- eller 6-ukers, faste eller fleksible dosestudier, forekom følgende bivirkninger i ≥5% forekomst hos pasientene som ble behandlet med FANAPT og minst to ganger placebo rotte i minst 1 dose: svimmelhet, munntørrhet, tretthet, nesetetthet, søvnighet, takykardi, ortostatisk hypotensjon og vekt økt. Svimmelhet, takykardi og vektøkning var minst dobbelt så vanlig på 20-24 mg / dag som på 10-16 mg / dag.
Ekstrapyramidale symptomer (EPS) i kliniske studier
Samlede data fra de 4 placebokontrollerte, 4- eller 6- ukers studier med fast eller fleksibel dose ga informasjon angående EPS. Data om bivirkninger samlet fra disse forsøkene viste følgende frekvenser av EPS-relaterte bivirkninger som vist i tabell 8.

Bivirkninger assosiert med seponering av behandling i kliniske studier
Basert på de samlede dataene fra 4 placebokontrollerte, 4- eller 6-ukers, faste eller fleksible doseringsstudier, var det ingen forskjell i forekomsten av seponering på grunn av bivirkninger mellom FANAPT-behandlet (5%) og placebo-behandlet (5%) pasienter. Typene bivirkninger som førte til seponering var like for FANAPT- og placebo-behandlede pasienter.
Demografiske forskjeller i bivirkninger i kliniske studier
En undersøkelse av befolkningsundergrupper i de 4 placebokontrollerte, 4- eller 6-ukers, faste- eller studier med fleksibel dose avdekket ingen bevis for forskjeller i sikkerhet på grunnlag av alder, kjønn eller rase.
Laboratorietest Abnormaliteter i kliniske studier
Det var ingen forskjeller mellom FANAPT og placebo i forekomsten av seponering på grunn av endringer i hematologi, urinalyse eller serumkjemi.
I kortvarige placebokontrollerte studier (4-6 uker) var det 1,0% (13/1342) iloperidonbehandlede pasienter med hematokrit minst en gang under det utvidede normale området under post-randomiseringsbehandling, sammenlignet med 0,3% (2/585) på placebo. Det utvidede normale området for senket hematokrit ble definert i hver av disse forsøkene som verdien 15% under normalområdet for det sentraliserte laboratoriet som ble brukt i forsøket.
Andre reaksjoner under evaluering av FANAPT før markedsføring
Følgende er en liste over MedDRA-termer som gjenspeiler bivirkninger hos pasienter behandlet med FANAPT ved flere doser ≥ 4 mg / dag i en hvilken som helst fase av en studie med databasen til 3210 FANAPT-behandlet pasienter. Alle rapporterte reaksjoner er inkludert bortsett fra de som allerede er oppført i tabell 7, eller andre deler av bivirkningene (6), de som er vurdert i Advarsler og forsiktighetsregler (5), de reaksjonsbetegnelsene som var så generelle at de var uinformative, reaksjoner rapportert hos færre enn 3 pasienter og som var verken alvorlige eller livstruende, reaksjoner som ellers er vanlige som bakgrunnsreaksjoner, og reaksjoner anses som usannsynlige å være medikamentelle i slekt.
Reaksjonene er videre kategorisert etter MedDRA-systemorganklasse og listet i rekkefølge av synkende frekvens i henhold til følgende definisjoner: hyppige bivirkninger er de som forekommer hos minst 1/100 pasienter (bare de som ikke er oppført i tabell 7 vises i dette listen); sjeldne bivirkninger er de som forekommer hos 1/100 til 1/1000 pasienter; sjeldne hendelser er de som forekommer hos færre enn 1/1000 pasienter.
Blod- og lymfesykdommer: Sjelden - anemi, jernmangelanemi; Rare-leukopeni
Hjertesykdommer: Hyppige - hjertebank; Sjelden - arytmi, første gangs atrioventrikulær blokkering, hjertesvikt (inkludert lunger og akutt)
Øre- og labyrintforstyrrelser: Sjelden - svimmelhet, tinnitus
Endokrine lidelser: Sjelden - hypotyreose
Øyesykdommer: Hyppig - konjunktivitt (inkludert allergisk); Sjelden - tørt øye, blefaritt, øyenlokkødem, hevelse i øyet, linseformet uklarhet, grå stær, hyperemi (inkludert konjunktival)
Mage- og tarmsykdommer: Sjelden - gastritt, spytt hypersekresjon, fekal inkontinens, magesår; Sjelden - afthous stomatitt, duodenalsår, hiatus hernia, hyperchlorhydria, leppesår, reflux esophagitis, stomatitis
Generelle lidelser og administrasjonsbetingelser: Sjeldent - ødem (generelt, pitting, på grunn av hjertesykdom), vanskeligheter med å gå, tørst; Sjelden - hypertermi
Hepatobiliary Disorders: Sjelden - kolelithiasis
Undersøkelser: Hyppig: vekten redusert; Sjelden - hemoglobin reduserte, antall neutrofiler økte, hematokrit reduserte
Metabolisme og ernæringssykdommer: sjelden - økt appetitt, dehydrering, hypokalemia, væskeansamling
Muskel- og skjelettplager: Hyppige - myalgi, muskelspasmer; Sjelden - torticollis
Forstyrrelser i nervesystemet: Hyppig parestesi, psykomotorisk hyperaktivitet, rastløshet, hukommelsestap, nystagmus; Sjeldne - rastløse bensyndrom
Psykiatriske lidelser: Hyppig - rastløshet, aggresjon, villfarelse; Sjelden - fiendtlighet, redusert libido, paranoia, anorgasmia, forvirringstilstand, mani, katatoni, humørsvingninger, panikk angrep, tvangslidelse, bulimia nervosa, delirium, polydipsi psykogen, impuls-kontroll lidelse, major depresjon
Nyresykdommer og urinveier: Hyppig - urininkontinens; Sjelden - dysuri, pollakiuri, enurese, nefrolithiasis; Sjelden - urinretensjon, nyresvikt akutt
Reproduksjonssystem og brystforstyrrelser: Hyppig - erektil dysfunksjon; Sjelden - testikkel smerter, amenoré, brystsmerter; Sjelden - uregelmessig menstruasjon, gynekomasti, menoragi, metrorragi, postmenopausal blødning, prostatitt.
Åndedretts-, thorax- og mediastinale lidelser: Hyppig - epistaksis, astma, rhinorrhea, bihule i lungene, tørrhet i nesen; Sjelden - tørr hals, søvnapné syndrom, dyspné anstrengelse
Postmarketing-opplevelse
Følgende bivirkninger er identifisert ved bruk av FANAPT etter godkjenning: retrograd utløsning og overfølsomhetsreaksjoner (inkludert anafylaksi; angioødem; tetthet i halsen; orofaryngeal hevelse; hevelse i ansiktet, leppene, munnen og tungen; urticaria; utslett; og kløe). Fordi disse reaksjonene ble rapportert frivillig fra en populasjon med usikker størrelse, er det ikke mulig å estimere frekvensen på en pålitelig måte eller etablere en årsakssammenheng til medisineksponering.
topp
Narkotikahandel
Gitt de primære CNS-effektene av FANAPT, bør forsiktighet utvises når det tas i kombinasjon med andre sentralt virkende medikamenter og alkohol. På grunn av sin - alfa-adrenerge reseptorantagonisme, har FANAPT potensial til å øke effekten av visse antihypertensive midler.
Potensial for andre medisiner å påvirke FANAPT
Iloperidon er ikke et underlag for CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 eller CYP2E1 enzymer. Dette antyder at en interaksjon av iloperidon med hemmere eller indusere av disse enzymene, eller andre faktorer, som røyking, er usannsynlig. Både CYP3A4 og CYP2D6 er ansvarlige for iloperidonmetabolismen. Hemmere av CYP3A4 (f.eks. Ketokonazol) eller CYP2D6 (f.eks. Fluoksetin, paroksetin) kan hemme eliminering av iloperidon og forårsake økte blodnivåer.
Ketokonazol: Samtidig administrering av ketokonazol (200 mg to ganger daglig i 4 dager), en kraftig hemmer av CYP3A4, med en 3 mg enkeltdose iloperidon til 19 friske frivillige i alderen 18-45 år økte området under kurven (AUC) for iloperidon og dets metabolitter P88 og P95 med 57%, 55% og 35%, henholdsvis. Iloperidondoser bør reduseres med omtrent halvparten når de administreres sammen med ketoconazol eller andre sterke hemmere av CYP3A4 (f.eks. Itrakonazol). Svakere hemmere (f.eks. Erytromycin, grapefruktjuice) er ikke studert. Når CYP3A4-hemmeren trekkes ut av kombinasjonsbehandlingen, bør iloperidondosen returneres til forrige nivå.
Fluoksetin: Samtidig administrering av fluoksetin (20 mg to ganger daglig i 21 dager), en kraftig hemmer av CYP2D6, med en enkelt 3 mg dose iloperidon til 23 friske frivillige, i alderen 29-44 år, som ble klassifisert som omfattende metabolisatorer av CYP2D6, økte AUC for iloperidon og dets metabolitt P88, omtrent 2- til 3 ganger, og reduserte AUC for metabolitten P95 med en halv. Doser av Iloperidon bør reduseres med halvparten når de gis sammen med fluoksetin. Når fluoksetin tas ut av kombinasjonsbehandlingen, bør iloperidondosen returneres til forrige nivå. Andre sterke hemmere av CYP2D6 kan forventes å ha lignende effekter og vil trenge passende dosereduksjon. Når CYP2D6-hemmeren trekkes ut av kombinasjonsbehandlingen, kan iloperidondosen økes til forrige nivå.
Paroksetin: Samtidig administrering av paroksetin (20 mg / dag i 5-8 dager), en kraftig hemmer av CYP2D6, med flere doser iloperidon (8 eller 12 mg to ganger daglig) til pasienter med schizofreni i alderen 18-65 år resulterte i økte gjennomsnittlige stabile toppkonsentrasjoner på iloperidon og dets metabolitt P88, med omtrent 1,6 ganger, og reduserte gjennomsnittlige stabile toppkonsentrasjoner av metabolitten P95 med en halv. Doser av Iloperidon bør reduseres med halvparten når de gis sammen med paroksetin. Når paroksetin tas ut av kombinasjonsbehandlingen, bør iloperidondosen returneres til forrige nivå. Andre sterke hemmere av CYP2D6 kan forventes å ha lignende effekter og vil trenge passende dosereduksjon. Når CYP2D6-hemmeren trekkes ut av kombinasjonsbehandlingen, kan iloperidondosen økes til tidligere nivåer.
Paroksetin og Ketokonazol: Samtidig administrering av paroksetin (20 mg en gang daglig i 10 dager), en CYP2D6-hemmer, og ketokonazol (200 mg) to ganger daglig) med flere doser iloperidon (8 eller 12 mg to ganger daglig) til pasienter med schizofreni i alderen 18-65 år resulterte i en 1,4 fold økning i jevn konsentrasjon av iloperidon og dets metabolitt P88 og en 1,4 ganger reduksjon i P95 i nærvær av paroksetin. Å gi iloperidon med hemmere av begge metabolske veier ga ikke effekten av den ene hemmeren gitt alene. Dosering av Iloperidon bør derfor reduseres med omtrent halvparten hvis den gis samtidig med både en CYP2D6 og CYP3A4-hemmer.
Potensial for FANAPT å påvirke andre legemidler
In vitro-studier på humane levermikrosomer viste at iloperidon ikke hemmer metabolismen i vesentlig grad medisiner metabolisert av følgende cytokrom P450 isozymer: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 eller CYP2E1. Videre viste in vitro-studier på humane levermikrosomer at iloperidon ikke har enzyminduserende egenskaper, spesielt for følgende cytokrom P450 isozymer: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 og CYP3A5.
Dekstrometorfan: En studie med friske frivillige viste at endringer i farmakokinetikken til dekstrometorfan (80 mg dose) når en 3 mg dose av iloperidon ble gitt samtidig resulterte i en økning på 17% i total eksponering og en 26% økning i de maksimale plasmakonsentrasjoner Cmax av dekstrometorfan. Dermed er en interaksjon mellom iloperidon og andre CYP2D6-underlag usannsynlig.
Fluoksetin: En enkelt dose på 3 mg iloperidon hadde ingen effekt på farmakokinetikken til fluoksetin (20 mg to ganger daglig).
Midazolam (et sensitivt CYP 3A4-underlag): En studie hos pasienter med schizofreni viste en under 50% økning i midazolam totalt eksponering ved iloperidon-steady state (14 dager med oral dosering med opptil 10 mg iloperidon to ganger daglig) og ingen effekt på midazolam C max. Dermed er en interaksjon mellom iloperidon og andre CYP3A4-underlag usannsynlig.
Legemidler som forlenger QT-intervallet FANAPT, bør ikke brukes sammen med andre medisiner som forlenger QT-intervallet.
topp
Bruk i spesifikke befolkninger
Eksponeringsregister for graviditet
Det er et register for eksponering for graviditet som overvåker graviditetsresultater hos kvinner utsatt for FANAPT under graviditet. For mer informasjon, kontakt Nasjonalt graviditetsregister for atypiske antipsykotika på 1-866-961-2388 eller besøk http://womensmentalhealth.org/clinical-and -research-program / pregnancyregistry /.
Risikosammendrag
Nyfødte med mødre som er utsatt for antipsykotiske medikamenter, inkludert FANAPT, i tredje trimester av svangerskapet er i faresonen for ekstrapyramidale og / eller abstinenssymptomer etter fødselen. De begrensede tilgjengelige dataene for FANAPT hos gravide er ikke tilstrekkelig til å informere medikamentassosiert risiko for store fødselsdefekter og spontanabort. Iloperidon var ikke teratogen når det ble gitt oralt til gravide rotter under organogenese i doser opptil 26 ganger den maksimale anbefalte humane dosen på 24 mg / dag på mg / m2 basis. Imidlertid forlenget det varigheten av graviditet og fødsel, økte dødfødsler, tidlige intrauterine dødsfall, økt forekomst av utviklingsforsinkelser og redusert overlevelse etter fødsel. Iloperidon var ikke teratogent når det ble administrert oralt til gravide kaniner under organogenese i doser opptil 20 ganger s MRHD på mg / m2 basis. Imidlertid økte det tidlige intrauterine dødsfall og reduserte fosterets levedyktighet ved termin ved den høyeste dosen, som også var en maternelt giftig dose.
Bakgrunnsrisikoen for store fødselsdefekter og spontanabort for den indikerte populasjonen er ukjent. I den amerikanske befolkningen generelt er den estimerte bakgrunnsrisikoen for store fødselsdefekter og spontanabort hos klinisk anerkjente graviditeter henholdsvis 2-4% og 15-20%.
Kliniske hensyn
Foster / neonatal bivirkninger
Ekstrapyramidale og / eller abstinenssymptomer, inkludert agitasjon, hypertoni, hypotoni, skjelving, søvnighet, respirasjonssykdom og mateforstyrrelse er rapportert hos nyfødte hvis mødre ble utsatt for antipsykotiske medisiner i løpet av tredje trimester av svangerskap. Disse symptomene har variert i alvorlighetsgrad. Noen nyfødte kom seg i løpet av timer eller dager uten spesifikk behandling; andre krevde langvarig sykehusinnleggelse. Overvåk nyfødte for ekstrapyramidale og / eller abstinenssymptomer og håndter symptomer på riktig måte.
Data
Dyredata
I en embryo-fosterutviklingsstudie ble gravide rotter gitt 4, 16 eller 64 mg / kg / dag (1,6, 6,5 og 26 ganger maksimal anbefalt human dose (MRHD) på 24 mg / dag på mg / m2 basis) av iloperidon oralt i løpet av perioden organogenesen. Den høyeste dosen forårsaket økte tidlige intrauterine dødsfall, redusert fostervekt og lengde, redusert fosterets skjelettbensdannelse, og økt forekomst av mindre fosterets skjelettanomalier og variasjoner; denne dosen forårsaket også redusert matforbruk av mor og vektøkning.
I en embryo-fosterutviklingsstudie ble gravide kaniner gitt 4, 10 eller 25 mg / kg / dag (3, 8 og 20 ganger MRHD på mg / m2 basis) av iloperidon i løpet av organogenesen. Den høyeste dosen forårsaket økte tidlige intrauterine dødsfall og redusert fosterets levedyktighet ved termin; denne dosen forårsaket også mors toksisitet.
I ytterligere studier der rotter ble gitt iloperidon i doser som ligner på det ovenstående, enten fra unnfangelsen eller fra svangerskapsdag 17 og fortsette gjennom avvenning, negative reproduktive effekter inkludert langvarig graviditet og fødsel, økt dødfødselstall, økt forekomst av fosterets viscerale variasjoner, redusert foster- og valpvekt, og redusert valp etter fødsel overlevelse. Det var ingen medikamentelle effekter på neurobeveksling eller reproduktiv utvikling av de overlevende ungene. Ingen effektdoser varierte fra 4 til 12 mg / kg, bortsett fra økningen i dødfødselhastigheter som forekom ved den laveste testede dose på 4 mg / kg, som er 1,6 ganger MRHD på mg / m2-basis. Mors toksisitet ble sett ved de høyere dosene i disse studiene.
Iloperidonmetabolitten P95, som er en viktig sirkulerende metabolitt av iloperidon hos mennesker, men ikke er til stede i betydelige mengder hos rotter ble gitt til gravide rotter i løpet av organogenesen i orale doser på 20, 80 eller 200 mg kg / dag. Ingen teratogene effekter ble sett. Forsinket beindannelse i skjelettet skjedde i alle doser. Ingen signifikant mors toksisitet ble produsert. Plasmanivåer av P95 (AUC) ved den høyeste dosen som ble testet var 2 ganger høyere enn hos mennesker som fikk MRHD av iloperidon.
amming
Risikosammendrag
Det foreligger ingen informasjon om tilstedeværelsen av iloperidon eller dets metabolitter i morsmelk effekter av iloperidon på et ammet barn, og heller ikke effekten av iloperidon på morsmelk produksjon. Iloperidon er til stede i rottemelk. På grunn av potensialet for alvorlige bivirkninger hos ammede spedbarn, råd en kvinne om ikke å amme under behandling med FANAPT.
Data Overføring av radioaktivitet til melke fra lakterende rotter ble undersøkt etter en enkelt dose [14C] iloperidon ved 5 mg / kg. Konsentrasjonen av radioaktivitet i melk 4 timer etter dosen var nær 10 ganger større enn den i plasma på samme tid. Imidlertid hadde konsentrasjonen av radioaktivitet i melk innen 24 timer etter dosering falt til verdier som var litt lavere enn plasma. Den metabolske profilen i melk var kvalitativt lik den i plasma.
Bruk av barn Sikkerhet og effektivitet hos barn og ungdommer er ikke fastslått.
Geriatrisk bruk
Kliniske studier av FANAPT i behandling av schizofreni inkluderte ikke tilstrekkelig antall pasienter over 65 år for å avgjøre om de reagerer annerledes enn yngre voksne pasienter. Av de 3210 pasientene som ble behandlet med FANAPT i premarketing-studier, var 25 (0,5%) ≥65 år gamle, og det var ingen pasienter ≥75 år gamle.
Eldre pasienter med demensrelatert psykose behandlet med FANAPT har en økt risiko for død sammenlignet med placebo. FANAPT er ikke godkjent for behandling av pasienter med demensrelatert psykose.
Nedsatt nyrefunksjon
Fordi FANAPT er sterkt metabolisert, med mindre enn 1% av legemidlet utskilt uendret, er det usannsynlig at nedsatt nyrefunksjon har betydelig innvirkning på farmakokinetikken til FANAPT. Nedsatt nyrefunksjon (kreatininclearance <30 ml / min) hadde minimal effekt på Cmax av iloperidon (gitt i en enkelt dose på 3 mg) og dets metabolitter P88 og P95 i hvilken som helst av de 3analytter som ble målt. AUC0– ∞ ble økt med 24%, redusert med 6% og økt med 52% for henholdsvis iloperidon, P88 og P95, hos personer med nedsatt nyrefunksjon.
Nedsatt leverfunksjon
Ingen dosejustering av FANAPT er nødvendig hos pasienter med lett nedsatt leverfunksjon. Pasienter med moderat nedsatt leverfunksjon kan kreve dosereduksjon. FANAPT anbefales ikke til pasienter med alvorlig nedsatt leverfunksjon.
Hos voksne personer med mild nedsatt leverfunksjon ble det ikke observert noen relevant forskjell i farmakokinetikk av iloperidon, P88 eller P95 (total eller ubundet) sammenlignet med sunne voksne kontroller. Hos personer med moderat nedsatt leverfunksjon var en høyere (to ganger) og mer variabel fri eksponering for de aktive metabolittene P88 observert sammenlignet med sunne kontroller, mens eksponeringen for iloperidon og P95 generelt var lik (mindre enn 50% endring sammenlignet med styre). Siden det ikke er utført en studie på alvorlige leverfunksjonspersoner, anbefales ikke FANAPT til pasienter med alvorlig nedsatt leverfunksjon.
Røykestatus
Basert på in vitro-studier som bruker humane leverenzymer, er FANAPT ikke et substrat for CYP1A2; røyking bør derfor ikke ha noen innvirkning på farmakokinetikken til FANAPT.
Svangerskap
topp
Narkotikamisbruk og avhengighet
Kontrollert stoff
FANAPT er ikke et kontrollert stoff.
Misbruke
FANAPT er ikke systematisk studert hos dyr eller mennesker på grunn av potensialet for misbruk, toleranse eller fysisk avhengighet. Selv om de kliniske studiene ikke avdekket noen tendens for medikament-søkende atferd, var disse observasjonene ikke systematiske og det er ikke mulig å forutsi på bakgrunn av denne erfaringen i hvilken grad et CNS-aktivt medikament, FANAPT, vil bli misbrukt, omdirigert og / eller misbrukt en gang markedsført. Følgelig bør pasienter evalueres nøye for en historie med rus, og slike pasienter bør være det observert nøye for tegn på misbruk eller misbruk av FANAPT (f.eks. utvikling av toleranse, økning i dose, medikament-søkende oppførsel).
topp
Overdosering dosering~~POS=HEADCOMP
Menneskelig erfaring
I studier før markedsføring som involverte over 3210 pasienter, var tilfeldig eller forsettlig overdose av FANAPT dokumentert hos 8 pasienter fra 48 mg til 576 mg tatt på en gang og 292 mg tatt over en 3-dagers periode. Ingen omkomne ble rapportert fra disse tilfellene. Den største bekreftede enkeltinntaket av FANAPT var 576 mg; ingen skadelige fysiske effekter ble observert for denne pasienten. Den neste største bekreftede inntak av FANAPT var 438 mg over en 4-dagers periode; ekstrapyramidale symptomer og et QTc-intervall på 507 msek ble rapportert for denne pasienten uten hjertesekvenser. Denne pasienten fortsatte FANAPT-behandlingen i ytterligere 11 måneder.
Generelt var rapporterte tegn og symptomer de som skyldes en overdrivelse av de kjente farmakologiske effektene (f.eks. Døsighet og beroligelse, takykardi og hypotensjon) av FANAPT.
Håndtering av overdose
Det er ingen spesifikk motgift for FANAPT. Derfor bør det iverksettes passende støttende tiltak. I tilfelle akutt overdose, skal legen etablere og vedlikeholde en luftvei og sikre tilstrekkelig oksygenering og ventilasjon. Mageskylling (etter intubasjon, hvis pasienten er bevisstløs) og administrering av aktivt kull sammen med et avføringsmiddel bør vurderes. Muligheten for obtundasjon, anfall eller dystonisk reaksjon av hode og nakke etter overdose kan skape risiko for aspirasjon med indusert emese. Kardiovaskulær overvåking bør starte umiddelbart og bør omfatte kontinuerlig EKG-overvåking for å oppdage mulige arytmier. Hvis det gis antiarytmisk behandling, bør ikke disopyramid, procainamid og kinidin brukes, da de har potensial for QT-forlengende effekter som kan være additive for FANAPT. Tilsvarende er det rimelig å forvente at de alfablokkerende egenskapene til bretylium kan være additive for FANAPT, noe som resulterer i problematisk hypotensjon. Hypotensjon og sirkulasjons kollaps bør behandles med passende tiltak som intravenøs væske eller sympatomimetiske midler (epinefrin og dopamin bør ikke brukes, siden beta-stimulering kan forverre hypotensjon i innstillingen av FANAPT-indusert alfa blokade). I tilfeller av alvorlige ekstrapyramidale symptomer, bør antikolinerg medisinering gis. Tett medisinsk tilsyn bør fortsette til pasienten kommer seg.
topp
Beskrivelse
FANAPT er en atypisk antipsykotisk tilhørende den kjemiske klassen piperidinyl-benzisoxazolderivater. Det kjemiske navnet er 4 '- [3- [4- (6-Fluoro-1,2-benzisoxazol-3-yl) piperidino] propoxy] -3'-methoxyacetophenon. Dens molekylformel er C24H27FN2O4 og dens molekylvekt er 426,48. Strukturformelen er:
Iloperidon er et hvitt til off-white fint krystallinsk pulver. Den er praktisk talt uoppløselig i vann, veldig lett oppløselig i 0,1 N HC1 og fritt løselig i kloroform, etanol, metanol og acetonitril.
FANAPT tabletter er kun beregnet på oral administrering. Hver runde, ubelagt
tablett inneholder 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg eller 12 mg iloperidon. Inaktive ingredienser er: laktosemonohydrat, mikrokrystallinsk cellulose, hydroksypropylmetylcellulose, crospovidon, magnesiumstearat, kolloidalt silisium
dioksid og renset vann (fjernet under prosessering). Tablettene er hvite, runde, flate, skråkantede og identifisert med en logo "" preget på den ene siden og tablettstyrken "1", "2", "4", "6", "8", "10", eller “12” preget på den andre siden.
topp
Klinisk farmakologi
Virkningsmekanismen
Virkemekanismen til iloperidon ved schizofreni er ukjent. Effekten av iloperidon kan imidlertid formidles gjennom en kombinasjon av dopamin type 2 (D2) og serotonin type 2 (5-HT2) antagonisme.
Iloperidon danner en aktiv metabolitt, P88, som har en in vitro reseptorbindingsprofil som ligner på det overordnede medikamentet.
farmakodynamikk
Iloperidon fungerer som en antagonist med høy (nM) affinitetsbinding til serotonin 5-HT2A dopamin D2 og D3-reseptorer og norepinefrin NEal-reseptorer (Ki-verdier på 5,6, 6,3, 7,1 og 0,36 nM, henholdsvis). Iloperidon har moderat affinitet for dopamin D4 og serotonin 5-HT6 og 5-HT7 reseptorer (Ki verdier på 25, 43 og 22, nM henholdsvis) og lav affinitet for serotonin 5-HT1A, dopamin D1 og histamin H1 reseptorer (Ki verdier på 168, 216 og 437 nM, henholdsvis). Iloperidon har ingen nevneverdig affinitet (Ki> 1000 nM) for kolinerge muskarinreseptorer. Affiniteten til iloperidonmetabolitten P88 er generelt lik eller mindre enn den for moderforbindelsen, mens bare metabolitten P95 viser affinitet for 5-HT2A (Ki-verdi på 3,91) og NEa1A-, NEa1B-, NEa1D- og NEa2C-reseptorene (Ki-verdier på 4,7, 2,7, 8,8 og 4,7 nM henholdsvis).
farmakokinetikk
Den observerte gjennomsnittlige eliminasjonshalveringstiden for iloperidon, P88 og P95 i CYP2D6 omfattende metabolisatorer (EM) er henholdsvis 18, 26 og 23 timer, og i dårlig metabolisator (PM) er henholdsvis 33, 37 og 31 timer. Steady-state konsentrasjoner oppnås innen 3 - 4 dager etter dosering. Iloperidon-akkumulering er forutsigbar fra farmakokinetikk med en dose. Farmakokinetikken til iloperidon er mer enn doseproporsjonal. Eliminering av iloperidon skjer hovedsakelig gjennom levermetabolisme som involverer 2 P450 isozymer, CYP2D6 og CYP3A4.
Absorpsjon: Iloperidon absorberes godt etter administrering av tabletten med topp plasmakonsentrasjon som oppstår i løpet av 2 til 4 timer; mens den relative biotilgjengeligheten av tablettformuleringen sammenlignet med oral løsning er 96%. Administrering av iloperidon med et måltid med høyt fettinnhold påvirket ikke signifikant Cmax eller AUC av iloperidone, P88 eller P95, men forsinket Tmax med 1 time for iloperidone, 2 timer for P88 og 6 timer i P95. FANAPT kan administreres uten hensyn til måltider.
Distribusjon: Iloperidon har en tilsynelatende klarering (klarering / biotilgjengelighet) på 47 til 102 L / t, med et tilsynelatende distribusjonsvolum på 1340-2800 L. Ved terapeutiske konsentrasjoner er den ubundne fraksjonen av iloperidon i plasma ~ 3% og av hver metabolitt (P88 og P95) er den ~ 8%.
Metabolisme og eliminering: Iloperidon metaboliseres primært ved 3 biotransformasjonsveier: karbonylreduksjon, hydroksylering (mediert av CYP2D6) og O-demetylering (mediert av CYP3A4). Det er to dominerende iloperidonmetabolitter, P95 og P88. Iloperidonmetabolitten P95 representerer 47,9% av AUC for iloperidon og dets metabolitter i plasma ved stabil tilstand for omfattende metabolisatorer (EM) og 25% for dårlig metabolisator (PM). Den aktive metabolitten P88 utgjør henholdsvis 19,5% og 34,0% av total plasmaeksponering i EM og PM.
Omtrent 7% -10% av kaukasiere og 3% -8% av svarte / afroamerikanere mangler kapasitet til å metabolisere CYP2D6 underlag og er klassifisert som dårlig metabolisator (PM), mens resten er mellomliggende, omfattende eller ultrarapid metabolizers. Samtidig administrering av FANAPT med kjente sterke hemmere av CYP2D6 som fluoksetin resulterer i en 2,3 ganger økning i eksponering for iloperidonplasma, og derfor bør halvparten av FANAPT-dosen være administreres.
Tilsvarende har PMs av CYP2D6 høyere eksponering for iloperidon sammenlignet med EM, og PM bør redusere dosen med halvparten. Laboratorietester er tilgjengelige for å identifisere CYP2D6 PM.
Hovedtyngden av de radioaktive materialene ble utvunnet i urinen (gjennomsnittlig 58,2% og 45,1% i henholdsvis EM og PM), med avføring utgjort 19,9% (EM) til 22,1% (PM) av den doserte radioaktiviteten.
Transporter-interaksjon: Iloperidon og P88 er ikke underlag til P-gp, og iloperidon er en svak P-gp-hemmer.
topp
Ikke-klinisk toksikologi
Karsinogenese, mutagenese, svekkelse av fruktbarhet
Karsinogenese: Levetidskarsinogenisitetsstudier ble utført på CD-1 mus og Sprague Dawley rotter. Iloperidon ble administrert oralt i doser på 2,5, 5,0 og 10 mg / kg / dag til CD-1 mus og 4, 8 og 16 mg / kg / dag til Sprague Dawley-rotter (henholdsvis 0,5, 1,0 og 2,0 ganger og 1,6, 3,2 og 6,5 ganger, MRHD på 24 mg / dag på en mg / m2 basis). Det var en økt forekomst av ondartede svulster i brystkjertelen hos kvinnelige mus behandlet med den laveste dosen (2,5 mg / kg / dag). Det var ingen behandlingsrelaterte økninger i neoplasi hos rotter.
Det kreftfremkallende potensialet til iloperidonmetabolitten P95, som er en viktig sirkulerende metabolitt av iloperidon hos mennesker, men ikke er tilstede i betydelige mengder hos mus eller rotter, ble vurdert i en livslang karcinogenisitetsstudie på Wistar-rotter ved orale doser på 25, 75 og 200 mg / kg / dag hos menn og 50, 150 og 250 (redusert fra 400) mg / kg / dag i hunner. Medikamentrelaterte neoplastiske forandringer forekom hos menn, i hypofysen (pars distalis adenoma) ved alle doser og i bukspyttkjertelen (holmencellet adenom) ved høy dose. Plasmanivåer av P95 (AUC) hos menn i testede doser (25, 75 og 200 mg / kg / dag) var henholdsvis omtrent 0,4, 3 og 23 ganger den menneskelige eksponeringen for P95 ved MRHD av iloperidon.
Mutagenese: Iloperidon var negativt i Ames-testen og i in vivo-benmarg- og rottelevermikronukleustestene. Iloperidon induserte kromosomavvik i CHO-celler (Chinese Hamster Ovary) in vitro ved konsentrasjoner som også forårsaket en viss cytotoksisitet.
Iloperidonmetabolitten P95 var negativ i Ames-testen, V79-kromosomavvikelsestesten og en in vivo mus benmargsmikronukleustest.
Nedsatt fertilitet: Iloperidon reduserte fruktbarheten ved 12 og 36 mg / kg i en studie der både hann- og hunnrotter ble behandlet. Dosen uten effekt var 4 mg / kg, som er 1,6 ganger MRHD på 24 mg / dag på mg / m2 basis.
topp
Kliniske studier
Effekten av FANAPT i behandlingen av schizofreni ble støttet av 2 placebo- og aktivt kontrollerte kortvarige (4- og 6-ukers) studier og en langsiktig placebokontrollert randomisert rettssak. Alle studier inkluderte pasienter som oppfylte DSM-III / IV-kriteriene for schizofreni.
Tre instrumenter ble brukt for å vurdere psykiatriske tegn og symptomer i disse studiene. Positive and Negative Syndrome Scale (PANSS) and Brief Psychiatric Rating Scale (BPRS) er begge varelager med flere elementer.
av generell psykopatologi som vanligvis brukes til å evaluere effekten av medikamentell behandling ved schizofreni. Evalueringen av klinisk global inntrykk (CGI) gjenspeiler inntrykk av en dyktig observatør, fullt kjent med manifestasjonene av schizofreni, om pasientens generelle kliniske tilstand.
En 6-ukers, placebokontrollert studie (n = 706) involverte 2 fleksible doseområder av FANAPT (12-16 mg / dag eller 20-24 mg / dag) sammenlignet med placebo og en aktiv kontroll (risperidon). For gruppen 12-16 mg / dag var titreringsplanen for FANAPT 1 mg to ganger daglig på dag 1 og 2, 2 mg to ganger daglig på dag 3 og 4, 4 mg to ganger daglig på dag 5 og 6, og 6 mg to ganger daglig på dag 7. For gruppen 20-24 mg / dag var titreringsplanen for FANAPT 1 mg to ganger daglig på dag 1, 2 mg to ganger daglig på dag 2, 4 mg to ganger daglig på dag 3, 6 mg to ganger daglig på dag 4 og 5, 8 mg to ganger daglig på dag 6, og 10 mg to ganger daglig på dag 7. Det primære endepunktet var endring fra baseline på BPRS-totalscore ved slutten av behandlingen (dag 42). Både 12-16 mg / dag og 20-24 mg / dag doseområdet for FANAPT var bedre enn placebo på BPRS total score. Det antipsykotiske medikamentet med aktiv kontroll syntes å være overlegen FANAPT i denne studien i løpet av de første 2 uker, et funn som delvis kan forklares med den raskere titrering som var mulig for det legemiddel. Hos pasienter i denne studien som forble i behandling i minst 2 uker, så det ut til at iloperidon hadde hatt sammenlignbar effekt med den aktive kontrollen.
En 4-ukers, placebokontrollert studie (n = 604) involverte en fast dose FANAPT (24 mg / dag) sammenlignet med placebo og en aktiv kontroll (ziprasidon). Titreringsplanen for denne studien var lik den for 6-ukers studien. Denne studien involverte titrering av FANAPT med start på 1 mg to ganger daglig på dag 1 og øking til 2, 4, 6, 8, 10 og 12 mg to ganger daglig på dag 2, 3, 4, 5, 6 og 7. Det primære endepunktet var endring fra baseline på PANSS totale poengsum ved behandlingens slutt (dag 28). FANAPT-dosen på 24 mg / dag var overlegen placebo i PANSS-totalscore. FANAPT så ut til å ha lignende effekt som det aktive kontrollmedikamentet, som også trengte en langsom titrering til måltosen.
I et lengre tidsstudie, oppfylte klinisk stabile voksne polikliniske pasienter (n = 303) DSM-IV-kriterier for schizofreni som forble stabile etter 12 uker med åpen merket behandling med fleksible doser FANAPT (8 mg / dag - 24 mg / dag administrert som to ganger daglig doser) ble randomisert til placebo eller for å fortsette med deres nåværende FANAPT-dose (8 mg / dag - 24 mg / dag administrert som to ganger daglige doser) for observasjon for mulig tilbakefall under dobbeltblind tilbakefall forebyggingsfase. Stabilisering under åpen etikettfase ble definert som å være på en etablert dose FANAPT som var uendret på grunn av effektiviteten i de fire ukene før randomisering, som har CGI-alvorlighetsgrad på ≤4 og PANSS total poengsum ≤70, en poengsum på ≤4 på hver av følgende individuelle PANSS-elementer (P1-vrangforestillinger, P2-konseptuell desorganisering, P3-hallusinatorisk oppførsel, P6 mistenksomhet / forfølgelse, P7-fiendtlighet eller G8-usamarbeid, og ingen sykehusinnleggelse eller økning i omsorgsnivå for å behandle eksaserbasjoner. Tilbakefall eller forestående tilbakefall under den dobbeltblinde forebygging av tilbakefall ble definert som en av de følgende: sykehusinnleggelse på grunn av forverring av schizofreni, økning (forverring) av PANSS total score ≥30%, CGI-
Forbedringsscore ≥6, pasienten hadde suicidal, homicidal eller aggressiv atferd, eller behov for andre antipsykotiske medisiner.

Basert på interimsanalysen, bestemte et uavhengig dataovervåkningsutvalg at studien skulle seponeres tidlig på grunn av bevis på effekt. Basert på resultater fra interimsanalysen, som ble bekreftet av det endelige analysedatasettet, ble pasienter behandlet med FANAPT opplevde en statistisk signifikant lengre tid til tilbakefall eller forestående tilbakefall enn pasienter som fikk placebo. Figur 1 viser den estimerte kumulative andelen av pasienter med tilbakefall eller forestående tilbakefall basert på det endelige datasettet.
topp
Hvordan leveres / lagring og håndtering
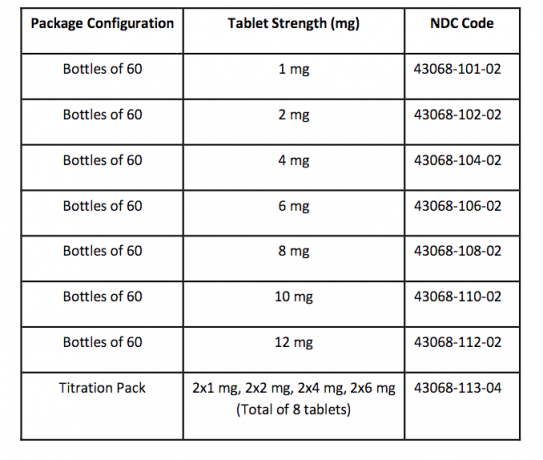
FANAPT tabletter er hvite, runde og identifisert med en logo preget på den ene siden og tablettstyrken "1", "2", "4", "6", "8", "10" eller "12" preget på den andre side. Nettbrett leveres i følgende styrker og pakkekonfigurasjoner:
Oppbevaring
Oppbevar FANAPT tabletter ved kontrollert romtemperatur, 25 ° C; utflukter tillatt til 15 ° til 30 ° C (59 ° til 86 ° F) [Se USP kontrollert romtemperatur]. Beskytt FANAPT-tabletter mot eksponering for lys og fuktighet.
PASIENTS RÅDINFORMASJON
Leger anbefales å diskutere følgende problemer med pasienter som de foreskriver FANAPT:
Forlengelse av QT-intervall
Pasienter bør rådes til å kontakte lege umiddelbart hvis de føler seg besvime, mister bevissthet eller har hjertebank. Pasienter bør rådes om ikke å ta FANAPT sammen med andre medisiner som forårsaker forlengelse av QT-intervall. Pasienter skal få beskjed om å informere legene om at de tar FANAPT før noe nytt legemiddel tas.
Nevroleptisk malignt syndrom
Pasienter og omsorgspersoner bør informeres om at et potensielt dødelig symptomkompleks noen ganger henvises til som NMS er rapportert i forbindelse med administrering av antipsykotiske medisiner, inkludert FANAPT. Tegn og symptomer på NMS inkluderer hyperpyrexia, muskelstivhet, endret mental status og bevis på autonom
ustabilitet (uregelmessig puls eller blodtrykk, takykardi, diaphorese og hjertedrytmi).
Metabolske endringer
Pasientene bør være klar over symptomene på hyperglykemi (høyt blodsukker) og diabetes mellitus. Pasienter som får diagnosen diabetes, de med risikofaktorer for diabetes, eller de som utvikler disse symptomer under behandlingen bør få blodsukkeret overvåket i begynnelsen av og med jevne mellomrom behandling. Pasienter bør informeres om at vektøkning har skjedd under behandling med FANAPT. Klinisk overvåking av vekt anbefales.
Ortostatisk hypotensjon
Pasienter bør informeres om risikoen for ortostatisk hypotensjon, spesielt når behandlingen starter, starter behandlingen på nytt eller øker dosen.
Interferens med kognitiv og motorisk ytelse
Fordi FANAPT kan ha potensial til å svekke dømmekraft, tenking eller motorikk, bør pasienter varsles om betjene farlige maskiner, inkludert biler, til de er rimelig sikre på at FANAPT-terapi ikke påvirker dem negativt.
Svangerskap
Rådgi pasienter om at bruk av Fanapt i tredje trimester kan forårsake ekstrapyramidale og / eller abstinenssymptomer hos en nyfødt. Rådgi pasienter om å varsle helsepersonell med kjent eller mistenkt graviditet.
Graviditetsregister
Gi råd til pasienter om at det er et graviditetseksponeringsregister som overvåker graviditetsresultater hos kvinner utsatt for FANAPT under graviditet
amming
Rådgiv kvinner om ikke å amme under behandling med FANAPT.
Samtidig medisinering
Pasienter bør informeres om å informere legene sine om de tar eller planlegger å ta reseptbelagte legemidler eller reseptfrie legemidler, siden det er potensial for interaksjoner.
Alkohol
Pasienter bør rådes til å unngå alkohol mens de tar FANAPT.
Varmeeksponering og dehydrering
Pasienter bør informeres om passende pleie for å unngå overoppheting og dehydrering.
Distribuert av:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 USA
Vanda og Fanapt® er registrerte varemerker for Vanda Pharmaceuticals Inc. i USA og andre land.
tilbake til toppen
Fanapt (Iloperidone) forskrivningsveiledning (PDF)
Informasjonen i denne monografien er ikke ment å dekke all mulig bruk, anvisninger, forsiktighetsregler, medikamentinteraksjoner eller uheldige effekter. Denne informasjonen er generalisert og er ikke ment som spesifikk medisinsk råd. Hvis du har spørsmål om medisinene du tar eller ønsker mer informasjon, bør du kontakte lege, apotek eller sykepleier.
sist oppdatert 07/13
tilbake til: Psykiatriske medisiner Farmakologisk hjemmeside


